我国是宫颈癌负担大国,每15分钟就有1人死于宫颈癌,不过幸运的是,宫颈癌是第一个明确找到病因的恶性实体肿瘤,高危型HPV的持续感染是引起宫颈癌的主要病因。据统计,70%~80%的女性在一生中的某个阶段都会感染HPV,但大多数是一过性感染,会被人体自身免疫系统清除,6~12个月就可转阴。一般认为连续2年及以上的感染叫持续感染,只有持续高危型HPV病毒感染,才有可能导致癌前病变,进而发展为宫颈癌。
研究显示不同型别HPV病毒的致病性不一致,并且HPV载量的高低对于病毒持续性感染的时间长短,致病性的强弱,宫颈病变的发生风险高低,都有一定的预测作用。硕世生物核心专利的21HPV分型定量检测可实现同步HPV分型及定量,其创造性采用人体单拷贝基因测定采集样本中的细胞数量,实现HPV分型定量检测的精准化,还可通过拓展分型定量分流HPV阳性人群,发挥HPV筛查的高敏感性,并优化筛查的特异性,最终让筛查进一步获益,本文汇总了近期相关研究进展。
01北大深圳医院CHIMUST研究
由北大深圳医院吴瑞芳教授牵头、美国克里夫兰医学中心及美国国际防癌组织(POI)协作,全国5家临床单位参与的基于人群的全国多中心横断面宫颈癌筛查研究。该研究选取了约10000名30~59岁,以往3年未进行过筛查且未怀孕的女性,进行医生采样及自采样对比评估,评价了硕世21HPV分型定量检测(BMRT)对宫颈癌初筛的有效性,及HPV分型定量作为HPV阳性分流指标的价值。
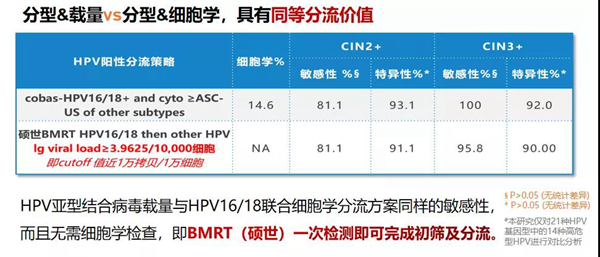
研究表明,硕世21HPV分型及定量检测与Cobas HPV具有同样的敏感性,而且特异性更高;且HPV分型结合病毒载量与HPV16/18联合细胞学分流方案具有同样的敏感性,而且无需细胞学检查,即BMRT(硕世)一次检测即可完成初筛及分流,可大大地提升筛查覆盖率,减少流失率,特别在一些交通不便,经济欠发达地区,有很好的应用价值。
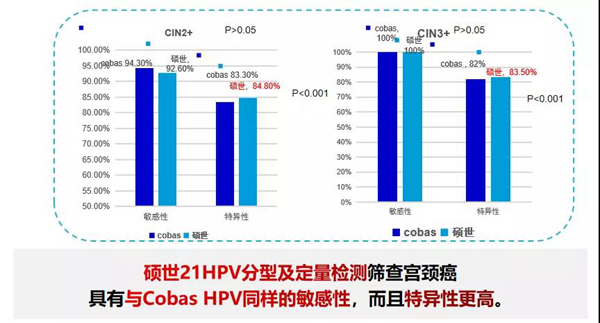
CHIMUST研究结果显示,使用HPV16/18病毒载量(cut-off值3.2929)、联合其他12种HR-HPV型的病毒载量(cut-off值3.9625)作为二次筛查策略时,与Cobas HPV16/18+联合细胞学≥ASC-US策略相比,对CIN2+和CIN3+的检出敏感性相似(P>0.05),可以通过分型结合病毒载量的方法替代细胞学进行二次筛查。
02福建省妇幼保健院FCLSCs研究
由福建省妇幼保健院孙蓬明教授团队牵头的FCLSCs研究,评估 HR-HPV 的病毒载量是否可以作为≥HSIL 风险分流的指标;参与研究人群为≥20岁女性, 于2012年1月~2016年10月,建立医院机会性筛查及社区系统筛查队列,具有完整的随访记录。在>120000 的筛查人群中,经过纳入标准的筛选,最后19446名女性入组。
该研究成果分别于2018年和2020年发表在《Cancer Management and Research》(癌症管理与研究)及《Medical Oncology》(内科肿瘤学)上。2018年研究结果表明:
(1)HPV16/31/33/52/58病毒载量与宫颈病变严重程度呈正相关,可获取特异基因型最优的病毒载量,作为宫颈病变(≥HSIL)筛查的临床cut off值。
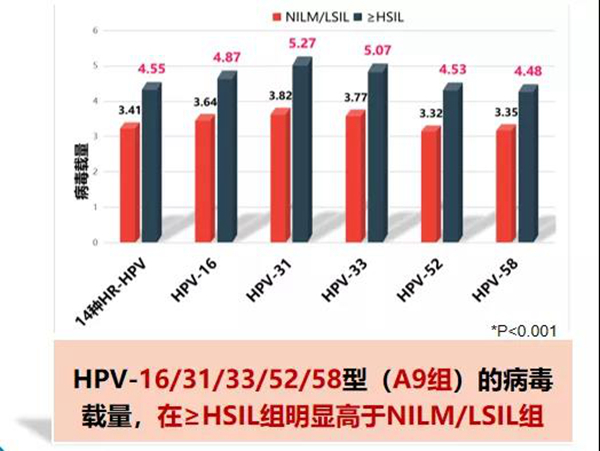
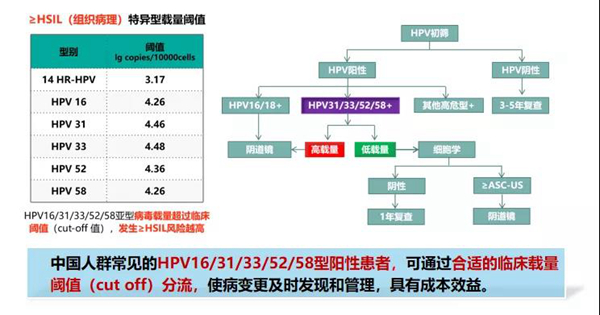
(2)HPV分型结合载量可作为HPV筛查阳性后筛选≥HSIL的分流工具;基于这些大样本研究数据,HPV分型结合定量检测有望成为一种不依赖于细胞学分流的新的客观筛查模式,符合单次就诊的要求。
(3)另外,2020年FCLSCs研究最新发表成果表明:术前HR-HPV病毒载量可以作为宫颈高级别病变术后预测病变残留的指标。
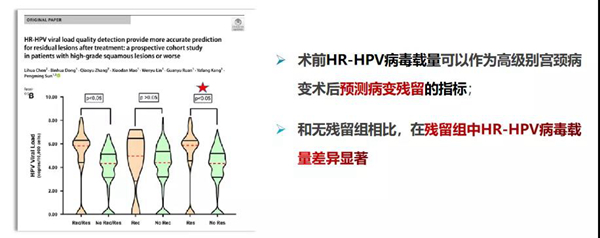
03复旦大学附属妇产科医院PMTaQS研究
2021年1月,硕世生物携手复旦大学附属妇产科医院(项目牵头单位)、联合绍兴市妇幼保健院、上虞妇幼保健院、徐州市妇幼保健院、徐州中心医院等7家中心,共同启动了长达7年的“分型定量HPV检测预测宫颈癌前病变前瞻性、多中心研究(PMTaQS研究)”。这将为填补我国宫颈癌防控领域的循证医学证据的空缺、制定符合中国国情的指南共识、促进2030WHO战略目标落地提供更加有力的证据支撑。

04国际前沿进展
关于HPV载量检测的意义,国内外已有众多研究成果。2019年,FDA文件确认高危型HPV病毒载量是与宫颈癌前病变相关的主要因素,尤其是alpha 9(A9组)家族的基因型,包括HPV16/31/33/35/52/58型。欧洲宫颈癌筛查路线的制定者Cuzick于2019年在Cancer Epidemiol Biomarkers发表了最新研究,是关于HPV基因型和病毒载量在预测宫颈高级别病变风险中的作用,研究结果表明:HPV的不同基因型和病毒载量是CIN2+和CIN3+的重要预测因子;特别是当HPV检测成为初筛策略时,根据HPV基因型和病毒载量来识别具有较高CIN2+和CIN3+风险的女性,这对于制定个体化的分诊计划很重要。
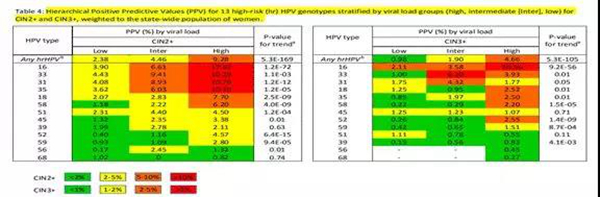
虽然这些只是当下国内外关于HPV分型结合定量优化宫颈癌筛查管理的初步的成果,相信随着大数据研究的积累,用HPV定量方式来分流HPV初筛阳性人群,将为未来宫颈癌防治提供更多的方式和选择。
05多样组合——HPV16+2及21 HPV分型定量
除了21HPV分型定量检测,硕世生物还开发了HPV16+2检测产品,能够满足大规模筛查需求,两款产品所覆盖的型别与2015年CFDA 《HPV核酸检测及基因分型试剂技术审查指导原则》推荐的18个型别完全一致;按照指南要求,硕世生物于2016年对两款产品启动了多中心、大样本、进行3年临床随访的Anita研究,研究评价两款HPV检测产品在宫颈癌筛查中的初筛、联合筛查和ASCUS分流三种预期用途的有效性及安全性;并对分型及定量的临床价值进行拓展研究,评价HPV不同型别载量与疾病进程的相关性。目前,两款产品的临床研究已于2020年年底顺利结题,正在申报国家药监局的产品注册证。随着药监局的新注册证被批准,临床将以国家药监局批准为依据应用,没批准的不能乱用于筛查,硕世两款产品相配合,在未来的宫颈癌筛查中一定能发挥更大的价值。
参考文献:
[1]. Ruifang Wu, et al. The application of BMRT-HPV viral load to secondary screening strategies for cervical cancer. 2020.
[2]. Pengming Sun , high-risk human papillomavirus viral load as a viable triage indicator for high-grade squamous intraepithelial lesion: a nested case–control study, Cancer Management and Research,30-Oct-2018.
[3]. Lihua Chen, Binhua Dong, Pengming Sun, et al. Medical Oncology,2020.
[4]. Rachael Adcock, Jack Cuzick, William C Hunt, et al. Cancer Epidemiol Biomarkers,2019.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号