双胎输血综合征(twin-twin transfusion syndrome,TTTS)是单绒毛膜双胎的严重并发症,其围生期发病率及病死率高达10-15%。为了更好的认识TTTS,美国母胎医学会(Society for Maternal-Fetal Medicine, SMFM)组织相关专家系统回顾了TTTS的自然病程、病理生理学、诊断、治疗方式等,推出了“双胎输血综合征临床指南”[1]。
TTTS通常的发病孕周为15-26周。几乎所有的单绒毛膜双胎中均存在血管交通支包括:静脉-静脉吻合(VV)、动脉-动脉吻合(AA)、动脉-静脉吻合(AV)。VV、AA吻合支在胎盘表面,存在双向的血流交换;而AV吻合位于胎盘深处,其交通支通常很丰富,血流交换总体维持平衡则不会发生TTTS,当双侧胎儿血流交换不平衡时导致TTTS疾病发生,而出现供血儿羊水过少,受血儿羊水过多。
1.TTTS的发病率
TTTS在单绒毛双羊膜囊双胎(MCDA)中发生率约8%-10%。
解读:据统计双胎中1/3为单卵双胎(MZ),而MZ双胎中MCDA双胎比例约占3/4。MCDA双胎是TTTS高危人群,约8%-10% MCDA合并TTTS;而在MZ双胎的双绒毛膜或单羊膜囊中TTTS的发生率极低。尽管试管婴儿中多数为双绒毛膜双胎,但MZ双胎发生率同时也增加了2-12倍,因此TTTS在试管婴儿中发生率高[2]。目前统计TTTS总体发生率约为1-3/10000 [3]。
2.TTTS诊断标准
TTTS诊断标准包括以下两点:(1)MCDA妊娠;(2)一侧胎儿羊水过少,最大羊水池深度(MVP)<2cm,一侧胎儿羊水过多MVP>8cm。指南仍推荐Quintero分期作为TTTS的分期系统。
解读:产前诊断TTTS主要根据超声测量,2cm及8cm分别代表MVP第5百分位及第95百分位。在MCDA双胎中若两侧羊水有主观差异而未达到诊断TTTS的标准,其进展为TTTS的几率<15%。ttts通常合并胎儿生长不一致、宫内生长受限(iugr)等,应注意ttts与上述疾病与鉴别诊断,同时应注意鉴别因胎儿畸形引起的双侧羊水差异,如消化道闭锁,泌尿系统发育异常等。双胎贫血—红细胞增多序列征(taps)病因也是胎盘微小血管交通支形成,但taps无羊水过少、过多序列征的表现[4]。
Quintero分期是TTTS应用最广的分期系统,根据疾病的严重程度将TTTS分为5期(见表1)。Quintero分期直观的将TTTS分为不同阶段,对疾病预后有预测作用,为治疗手段效果提供了一个有效的评估方法,方便与病人的沟通及治疗方案选择。研究发现随着TTTS疾病的进展,胎儿心血管功能随之改变,一些学者尝试添加心功能优化Quintero分期或建立新的评分系统。但专家组总结认为,目前尚无充分的数据支持修改Quintero分期系统或采用新的评分系统。

3.超声监测
指南推荐MCDA双胎从16周起,每2周一次超声检查直至分娩。
解读:TTTS通常发生在中孕期。TTTS病情是动态变化的,可维持稳定直至分娩、自发恢复正常、缓慢进展或表现正常的双胎几天内病情迅速恶化[5]。目前尚无随机对照试验的数据建议最佳的超声检查频次,用于监测MCDA妊娠TTTS的发生。指南推荐所有的双胎妊娠应于10-13周行超声检查,评估胎儿是否存活、绒毛膜性、头臀长、颈部透明层厚度。MCDA双胎16周以后,每2周一次超声检查,至少应该包括双侧胎儿MVP和膀胱检查(见图1)。
胎儿脐动脉血流频谱也应监测,特别是存在双侧胎儿羊水量或者生长差异时。在双侧胎儿生长不一致的MCDA妊娠中,胎盘占有比例差异及帆状脐带入口的比例更高。胎盘占有比例差异在MCDA妊娠中发生率约为20%,且可同时合并TTTS,使该病的诊断及治疗更加复杂。比如异常的胎儿脐动脉血流可能是因为占有胎盘比例少,也可能继发于TTTS疾病。MCDA妊娠中,脐动脉舒张期血流异常与疾病恶化而需要即刻分娩相关[6]。因此,指南指出MCDA双胎脐动脉血流监测也应该每两周一次。
MCDA妊娠早、中孕期的一些超声指标与TTTS有关。14周前双胎头臀长差异、NT增宽、静脉导管a波倒置或异常,上述指标异常时TTTS发病风险增加[7],应每周一次超声检查。约1/3 TTTS病例中存在帆状脐带入口、而>1/3羊膜隔折叠表现的双胎与TTTS发展有关[8]、供血儿胎盘回声增强与TTTS相关[9],上述超声指标可能提高TTTS的诊断率,但不推荐作为常规超声筛查项目。
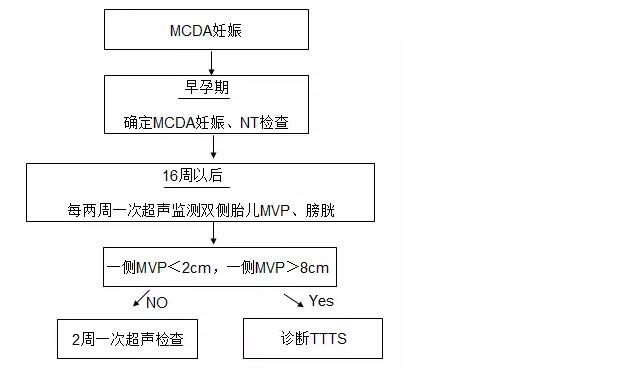
图1 MCDA妊娠超声检查
4.先天性心脏病的筛查
单绒毛膜双胎特别是合并有TTTS者,应行胎儿先天性心脏病筛查。
解读:与人群中先天性心脏病发病率0.5%相比,MCDA双胎先天性心脏病的危险度增加9倍,而TTTS胎儿中先天性心脏病危险度增加14倍[10]。统计表明MCDA双胎中先天性心脏病的发生率为2%,TTTS双胎先天性心脏病的发生率为5%,且在受血儿中更常见[11]。先天性心脏病例中多数为微小的室间隔缺损,而右室流出道梗阻报道率也逐渐增加。
TTTS双胎中心脏功能异常最初发生在受血儿。容量负荷增加导致肺动脉和主动脉流速增加、心脏扩大、房室瓣反流。随时间进展为心室肥大、舒张功能减退,右室收缩功能障碍而进一步引起右室流出道梗阻、肺动脉狭窄[12]。供血儿心功能正常比例较受血儿高,受血儿则可能发生心室肥大(61%)、房室瓣反流(21%)、右心室(50%)或左心室功能异常(58%)[13]。受血儿中约10%进展为右室流出道梗阻,其发生与多因素相关包括:前负荷、后负荷增加,循环因子肾素、血管紧张素等的共同作用。受血儿心血管功能异常与不良围生期结局相关,而受血儿心功能正常者围生期存活率较高[14]。
评估胎儿心脏舒张、收缩功能应用最广泛的Tei指数,已用于TTTS胎儿心功能的评估。尽管胎儿超声心动图检查没有纳入TTTS分期,分析显示TTTS分期越高胎儿心功能越差,而10%左右的早期TTTS胎儿仍存在心脏功能障碍[15]。胎儿超声心动图作为TTTS选择干预手段的指标,其远期作用需要进一步的研究。
5.与TTTS患者的沟通
指南推荐应多方面与TTTS患者沟通包括:TTTS的自然病程、不同治疗方式及风险、优势等。超过3/4 的I期TTTS可以保持病情稳定或自然恢复,TTTS分期高于Ⅲ期,特别是诊断孕周小于26周时胎儿围产期丢失率为70%-100%。TTTS可选择的治疗手段包括:(1)期待疗法,(2)羊水减量术,(3)羊膜隔造口术,(4)胎儿镜胎盘血管交通支激光凝固术,(5)选择性减胎,(6)终止妊娠。(见图2)。
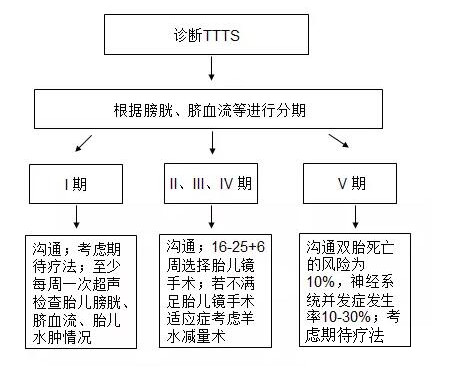
图2 不同分期TTTS治疗方案选择
解读:TTTS按照Quintero分期,I期占11%-15%、II期占20%-40%、III期占38%-60%、IV期占6%-7%、V期占2%。I期TTTS可以依次进展为II、III、 IV、V期,或也会直接进展至任意阶段,其进展过程通常难以预测。超过3/4的I期TTTS不用采取任何侵入性治疗,可以维持病情稳定或者恢复正常。而分期高于III期的TTTS自然病程预后不佳,围产期期胎儿丢失率为70%-100%,特别妊娠小于26周者[16]。TTTS双胎中一胎存活比例15%-70%,其存活比例与孕周和分期有关。缺乏有预测价值的自然病程及TTTS进展的不确定性,给临床管理MCDA双胎带来很大的挑战。
期待疗法:即不采取任何干预措施,而目前缺乏TTTS不同分期特别是分期较高的患者采用期待疗法的预后数据。
羊水减量术:妊娠14周后任何孕周均可行羊水减量术。目的是减少受血儿羊水量,通常纠正受血儿MVP至<5cm或<6cm。可一次或者重复多次行羊水减量术。从理论上讲,羊水减量术减少了羊膜及胎盘内血管的压力,潜在的促进胎盘血液循环,因此有可能降低因羊水过多导致的早产,羊水减量术后围产儿存活率为60%-65%[17]。羊水减量术的重复操作增加了未足月胎膜早破、早产、子宫破裂、感染、胎儿死亡等并发症。另外任何侵入性操作都可能引起出血、绒毛膜羊膜分离、不经意的羊膜造口、胎膜早破而影响胎儿镜手术的操作及成功率。
羊膜隔造口术:在分隔处使用穿刺针人为造口,使双侧羊膜囊中羊水等量。穿刺方向通常从供血儿到受血儿侧,如果术后48小时供血儿羊水无增加需要重复行羊膜隔造口。羊膜隔造口术治疗无优势且可能人为导致单羊膜双胎,因此普遍不再使用羊膜隔造口术作为TTTS的治疗方式。
胎儿镜下激光凝固胎盘血管交通支:激光消融血管的目的是功能上将胎盘分成两部分,术中先阻断供血儿-受血儿A-V吻合支,然后受血儿-供血儿A-V吻合支。Senat MV等报道胎儿镜手术治疗TTTS的适应症:15-26周MCDA妊娠;受血儿≤20周,MVP≥8cm或 >20周,MVP≥10cm及膨胀的膀胱;供血儿MVP≤2cm[18]。Crombleholme等报道胎儿镜手术治疗TTTS的适应症:<24周MCDA妊娠;受血儿MVP>8cm;供血儿MVP≤2cm及膀胱不可见[19]。激光阻断血管交通支是目前公认的最有效的治疗TTTS的手段。
选择性减胎或终止妊娠:<24周的ttts患者若合并有严重的双侧胎儿胎盘比例不均、iugr、一胎严重畸形或有严重脑损伤,可行选择性减胎术或终止妊娠。
6.I期TTTS治疗方案选择
指南推荐I期TTTS因为围产儿存活率约86%,通常采用期待疗法。
解读:Meta分析显示I期TTTS胎儿镜手术治疗后,双胎存活比例为75%,总体存活率83%,其存活率与期待治疗无显著性差异[20]。回顾性研究提示I期TTTS存活率在期待治疗、羊水减量术、胎儿镜手术中分别为86%,77%,86%[21]。因此有充分证据支持I期TTTS应采用保守治疗的方式。
7.II、III、IV期TTTS治疗方案选择
对于孕周<26周ii、iii、iv期ttts,多数专家认为胎儿镜胎盘血管交通支激光凝固术是最佳的治疗方法,胎儿镜手术总体围产儿死亡率约30%-50%,神经系统障碍约为5%-20%。
解读:TTTS II-IV期患者最佳的治疗方式为胎儿镜手术,尽管如此双胎同时存活的比例仅为50%左右,总体存活率为50%-70%[22]。胎儿镜手术并发症包括:未足月胎膜早破、早产、羊水渗漏、阴道出血、绒毛膜羊膜炎、血管交通支再形成致TTTS复发或TAPS等。一项多中心的研究显示,胎儿镜术后供血儿死亡的比例为24%,受血儿死亡的比例为17%。术后其中一胎或者双胎存活与下列因素有关:胎盘分布比例不均;受血儿合并IUGR、静脉导管a波倒置或者水肿者;术前供血儿合并IUGR同时伴舒张期血流异常者,其术后死亡风险增加20%-40%。
受血儿心脏功能一般在术后4周恢复正常。约20%分期较高的受血胎儿存在肺动脉瓣膜受损,少于1/3的肺动脉瓣受损在胎儿镜手术后恢复正常,大多数需要出生后治疗,87% 受血儿在2岁以内心功能可恢复正常。
无论是否采取治疗措施,神经系统功能障碍都是TTTS严重的长期并发症。MCDA妊娠中TTTS组合并严重脑损害如脑室周围白质软化、3级或4级脑室内出血的比例(10%)较非TTTS组高(2%)。Salomon等研究结果显示胎儿镜手术组较羊水减量术组脑室周围出血比例低,随访至生后6月神经系统并发症比例可能更低;但是随访至6岁TTTS存活者合并的主要神经系统障碍在胎儿镜手术组及羊水减量术组无显著差异[23]。胎儿镜手术后?期TTTS合并神经系统后遗症比例≤3%,总体神经系统障碍比例约5%-20%。超声检查及MRI检查均可用于胎儿脑部异常的评估,目前缺乏足够的数据推荐MRI检查作为常规的神经系统检查。
8.糖皮质激素的应用
指南指出MCDA合并TTTS妊娠者因其早产风险高,应推荐在24-33+6周使用一个疗程的地塞米松促进胎儿肺成熟,特别是对于分期≥Ⅲ期以及准备采取侵入手段干预治疗的TTTS患者。
9. TTTS分娩时间
TTTS最佳分娩时间取决于多因素,包括:疾病分期及严重程度、进展、干预效果、出生前检查结果。指南推荐34-36周为分娩最佳时间。
解读:目前尚无临床研究推荐TTTS妊娠最佳的分娩时间。分娩时间取决于多因素。分娩的时间推荐根据病情具体分析,病情较轻者可34-37周分娩,病情较重者可能考虑32-34周分娩。研究显示胎儿镜术后者分娩的平均孕周为33-34周,胎儿镜术者分娩时间与TTTS分期及手术操作相关的并发症相关。指南中推荐最佳分娩时间为34-36周。
参考文献:略
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号