Rh血型抗原共有5种,即D、C、c、E和e。由于D抗原是最早被发现的,且抗原性最强,故临床上将D抗原阳性者称为Rh阳性,无D抗原者称为Rh阴性[1]。母胎Rh血型不合所致胎儿溶血是由于Rh阴性母体产生了针对Rh阳性胎儿血型抗原的特异性抗体,特异性抗体通过胎盘进入胎儿循环,引起胎儿红细胞破坏,从而发生进行性溶血,可引起胎儿贫血、心力衰竭、水肿,甚至死胎或新生儿死亡等严重后果[2]。与欧美Rh阴性人群的发生率(10%~30%)比较,中国人群Rh阴性比例约为0.3%[3]。但我国临床医师在此方面的经验尚不足。现总结国际上针对Rh阴性血型不合的临床处理指南及相关文献,以供临床参考。
一、母胎Rh阴性血型不合的发生及预防
1. Rh(D)同种免疫发生的原因:母胎Rh阴性血型不合是由Rh(D)同种免疫导致的。研究表明,孕期未注射Rh(D)免疫球蛋白的Rh阴性孕妇如分娩Rh阳性新生儿,则有16%会发生同种免疫,其中2%在分娩时发生,7%在产后6个月内发生;其余7%虽然被致敏,但由于致敏太微弱而不能检测到抗体,当再次妊娠Rh(D)阳性的胎儿时,则会显现出来[4]。接近90%的同种免疫发生在分娩时的母胎输血,而10%是由于产前自发母胎输血,绝大多数发生在孕晚期[5]。导致发生同种免疫的Rh阳性血量非常少,母胎输血仅需不到0.1 ml即可发生[6]。其他发生在早孕期和中孕期的事件,如人工流产、自然流产、先兆流产、异位妊娠等,或其他破坏绒毛膜蜕膜间隙的临床操作,如绒毛膜穿刺、羊膜腔穿刺和脐静脉穿刺等,均可引起Rh(D)同种免疫的发生。孕晚期外倒转术无论成功与否,均可引起母胎输血,亦可引起Rh(D)同种免疫的发生[5]。
2.母胎Rh阴性血型不合的预防:30多年前,在欧美国家,母胎Rh阴性血型不合导致的胎儿及新生儿疾病是较常见的问题。1968年,随着产后广泛应用抗D免疫球蛋白,即非致敏Rh阴性孕妇分娩后72 h内注射合适剂量的抗D抗体,减少了约90%的Rh(D)同种免疫及随后发生的Rh相关的胎儿和新生儿溶血等问题[7]。28~29孕周预防性应用Rh免疫球蛋白,可将孕晚期Rh(D)同种免疫发生率从2%降至0.1%[6],将随后发生的Rh相关胎儿和新生儿问题阻断率从95%升高至99%[8],使Rh(D)相关新生儿病死率从1969年前的46/10万降至1990年的1.6/10万[9]。美国国家卫生统计中心2003年报告,发生Rh阴性血型不合同种免疫发生率为6.8例/1 000例活产儿[10]。产前宫内输血技术的实施和受累胎儿适时终止妊娠,均提高了新生儿存活率[11-12]。宫内输血技术使单纯严重贫血胎儿的存活率提高到90%以上,而贫血合并水肿胎儿的存活率也达到70%[13]。但需要注意的是,以上数据均来自发达国家,而发展中国家尚缺乏广泛应用抗D免疫球蛋白的经验。故Rh阴性血型不合导致的胎儿及新生儿问题仍较突出,且缺乏相关的统计数据。
Rh(D)同种免疫一旦发生,使用抗D免疫球蛋白无效。故Rh阴性孕妇一旦妊娠Rh阳性胎儿,如存在发生母胎输血的风险,即可应用抗D免疫球蛋白。罕见情况下,已经致敏的女性在再次妊娠的孕早期间接Coomb's试验阴性,前次妊娠原发免疫反应已发生,在本次妊娠后期可能产生抗D免疫球蛋白,孕妇注射抗D免疫球蛋白不能预防此类免疫反应[14-15]。
二、母胎Rh阴性血型不合孕期合理监测策略
美国母胎医学学会2015年发布了“胎儿贫血的诊断与处理临床指南”[5],提出孕期红细胞同种免疫的临床处理流程(图1),需要特别注意以下4个问题。
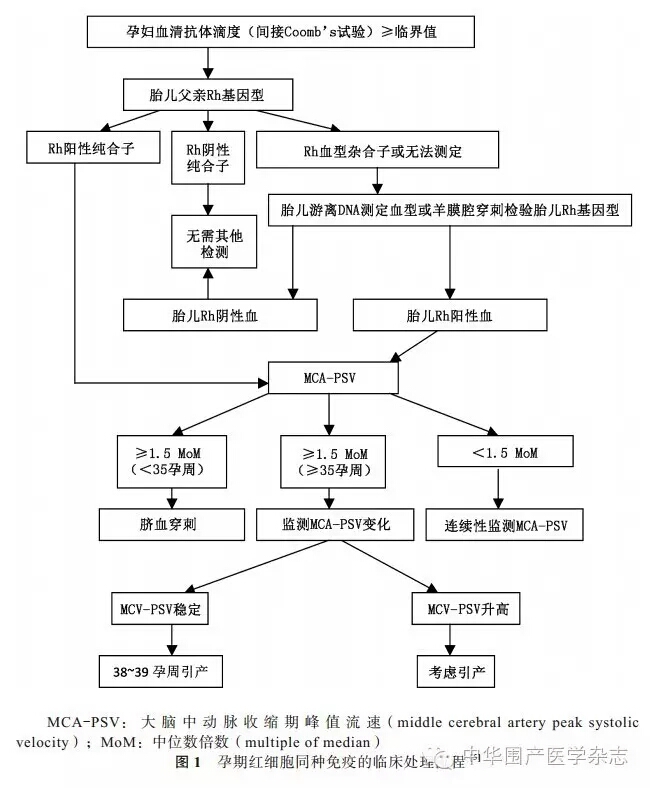
1.判断Rh阴性孕妇是否致敏:所有Rh阴性孕妇首次就诊时,均应行间接Coomb's试验,筛查有无抗D抗体。如果抗体阳性,则孕妇已经致敏;如果为阴性,则未致敏。根据既往妊娠时胎儿是否出现溶血,可分为首次致敏和再次致敏。大多数首次致敏的孕妇,孕期只需定期监测抗体水平,如滴度超过临界值,建议监测胎儿大脑中动脉收缩期峰值流速(middle cerebral artery peak systolic velocity,MCA-PSV)。而对再次致敏者,本次妊娠胎儿的受累程度较前次妊娠有加重的趋势,更可能需要宫内干预。且再次致敏的孕妇的抗体滴度不足以评估病情程度及胎儿溶血风险,故孕期不建议检查抗体滴度[13]。
2.孕妇血清间接Coomb's试验的意义和临界值的确定:初次与再次致敏的Rh阴性孕妇的孕期处理不同。初次致敏病情通常较轻,而再次致敏者每次妊娠均加重。间接Coomb's试验仅用于初次致敏孕妇的病情监测,且仅为筛查性试验,即检查胎儿是否存在溶血风险,而不是借此方法诊断已经发生的溶血,或预测溶血是否将出现进展。在临界值以下时,仍有发生轻到重度贫血的风险,但发生严重胎儿溶血性贫血机会很小。目前各机构实验室间的方法学不同,故均应建立本单位的临界值,大多数中心的临界值为1∶(8~32)。初次致敏者,20孕周后只要滴度在临界值以下,就可隔2~4周重复测定抗体滴度。如果达到或超过临界值,通常有2种选择,其一是行胎儿游离DNA检测Rh血型,或行羊膜腔穿刺,以明确胎儿Rh基因型;其二是行超声评价胎儿MCA-PSV[5]。
3.孕妇血清间接Coomb's试验阳性者的后续处理:欧美国家人群中Rh阴性比例较高,相关研究较为深入。当初次致敏孕妇行间接Coomb's试验阳性,即建议先行胎儿父亲Rh基因型检查。如父亲亦为血型Rh阴性时,因Rh血型系统已明确为单基因隐性遗传,即基因型为dd,故胎儿血型亦可推断为Rh阴性,不存在母胎Rh阴性血型不合的风险,临床无需监测。如胎儿父亲为Rh阳性纯合子,即基因型为DD,即故胎儿血型亦可推断为Rh阳性,存在发生母胎Rh阴性血型不合的风险,而建议动态监测胎儿MCA-PSV。如测定胎儿父亲Rh基因型相对困难,则建议行胎儿游离DNA测定血型,或行羊膜腔穿刺检测胎儿Rh基因型,同时告知介入性操作有致敏的可能,术后应给予Rh免疫球蛋白。来自美国的一项研究发现,非致敏Rh阴性母体血清游离DNA测定胎儿Rh(D)基因型的敏感性达97.2%,特异性达96.8%[16]。由于我国目前尚未普及母体血清游离DNA测定胎儿Rh(D)基因型技术,故孕期初次致敏,且间接Coomb's试验阳性者,应首先检测胎儿父亲的血型。如胎儿父亲的血型为Rh阴性,则孕期无需特殊处理;如为Rh阳性,则不除外胎儿血型为Rh阴性,建议行胎儿超声测量MCA-PSV。
4.孕期胎儿超声测量MCA-PSV对母胎Rh阴性血型不合的意义:2000年,Mari等[17]首次报道,应用无创性超声多普勒技术测量MCA-PSV以检测非水肿胎儿中、重度贫血,敏感性为100%,假阳性率为12%。2009年的一项meta分析评价了MCA-PSV对胎儿贫血的诊断价值发现,MCA-PSV诊断胎儿重度贫血的敏感性为75.5%,特异为90.8%;通过监测MCA-PSV的变化趋势,可以将假阳性率控制在5%以内[18]。2005年的一项研究评价了MCA-PSV在同一操作者和不同操作者之间的稳定性,结果发现,于颈内动脉分出大脑中动脉后2 mm测量MCA-PSV,其结果具有最佳稳定性[19]。由于MCA-PSV≥1.5 中位数倍数(multiple of median,MoM)时应直接行介入性操作,故在临床决定前,需要对超声医师进行合理培训,推荐不同的超声医师同时对高危孕妇进行MCA-PSV测量[19]。基于临床经验,美国母胎医学学会在其2015年公布的指南[5]中,提出了规范测量MCA-PSV的步骤,包括:(1)胎儿休息一段时间之后,需要取蝶骨水平过胎儿头部横切面;(2)彩色多普勒显示Willis环;(3)选择临近探头侧的MCA区域进行测量;(4)需要显示MCA的整体长度;(5)放大MCA-PSV,使MCA占据屏幕图像大小的50%;(6)MCA-PSV测量段需要紧邻颈内动脉发出大脑中动脉处;(7)理想状态下,血流方向和超声束方向应尽可能平行于动脉的整体长度;(8)显示MCA流速波形,并测量PSV的最高点。一般建议在胎儿安静状态下(无呼吸和运动)测量,至少重复测量3次,并取最高流速作为临床参考。如果血流方向和超声束的方向无法平行,建议调整角度后再次测量。
针对开始测量MCA-PSV的时机和测量频率等问题,目前尚无定论。但由于孕周过小,脐静脉穿刺或胎儿宫内输血困难,故通常建议自18~20孕周起测量MCA-PSV,进入围产期后建议每周复查。对于MCA-PSV偏高或超声有异常提示者,建议增加MCA-PSV的测量频率。
三、胎儿贫血与宫内输血
(一)胎儿贫血的诊断
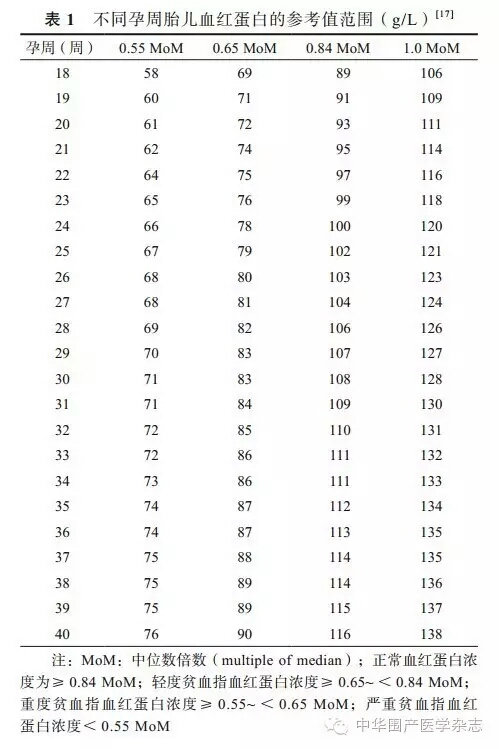
不同孕周胎儿血红蛋白正常值和贫血定义与分类见表1[17]。正常血红蛋白为≥本孕周血红蛋白的0.84 MoM,其中≥0.65~<0.84 MoM为轻度贫血,≥0.55~<0.65 MoM为中度,<0.55 MoM为重度。胎儿宫内输血指征即为胎儿贫血。筛查胎儿贫血的最理想方式是测量胎儿的MCA-PSV。如测得MCA-PSV≥1.5 MoM,则建议行脐静脉穿刺明确诊断。由于脐静脉穿刺后有可能需要胎儿宫内输血,建议考虑为胎儿贫血、且可能需宫内输血的孕妇转诊至有诊疗经验的胎儿医学中心。
(二)胎儿宫内输血的指征和途径
1.宫内输血的指征:虽然胎儿贫血诊断以胎儿血红蛋白浓度为标准,但目前国际上胎儿宫内输血的指征均为红细胞压积<0.30。
2.输血的途径:首选血管内输血。应根据胎盘位置、胎儿孕周决定。超声引导下脐静脉输血是应用最为广泛的途径。理想状态下,选择脐带插入胎盘处作为穿刺部位。但有时因后壁胎盘胎儿遮挡,可造成操作困难。如果采用游离段输血,推荐在操作前使用胎儿肌松药物[5],以免发生由胎动导致的穿刺针移位或血管撕裂等严重并发症。如果脐静脉穿刺困难,可选择行肝内静脉作为输血途径。如孕周过小(<20孕周),血管内输血困难,可尝试应用腹腔内输血。
(三)胎儿宫内输血的操作
1.术前准备:
(1)术前签订知情同意书。
(2)预备Rh阴性O型血、红细胞压积75%~85%新鲜辐照少白细胞红细胞100~200 ml(采集时间尽量在3~5 d内),筛查感染性疾病及巨细胞病毒均阴性,不规则抗体阴性。
(3)检查母体血常规、凝血功能、肝肾功能、感染相关标记物,孕妇穿刺当日体温不能超过37.5℃。如超过28孕周,则建议常规给予地塞米松促胎肺成熟。
(4)准备胎儿肌松药物(顺式阿曲库铵0.2 mg/kg),包括注射器稀释好的肝素。局部麻醉使用利多卡因。
2.操作地点:对于≥28孕周,已进入围产期的孕妇,建议在手术室行宫内输血。如胎心持续异常,必要时可行剖宫产终止妊娠。
3.操作方法:先行超声检查,决定脐带穿刺点。尽量选择脐带插入胎盘处作为穿刺点。脐带穿刺成功,如为脐带插入胎盘附着处,应先确认为胎儿血;如为游离端或肝内静脉,则无需行胎儿血确认试验。脐静脉穿刺成功后取2 ml血行血常规检查,2 ml血行血型测定,1 ml血行胎儿血气分析,必要时2 ml行染色体分析。在整个输血过程中,尽量保持超声监测脐带附着处,观察脐血是否持续通过脐静脉流入。首次穿刺成功,在确认胎儿血红蛋白、红细胞压积和预期输血量的同时,缓慢输入红细胞(速度为1 ml/min),防止凝血发生。明确输血量后,按照输血速度2~5 ml/min设置输液泵(预计输血量计算见表2)[20]。在输血过程中,应尝试从输液三通管内不断回抽血液,保证穿刺针一直保持在脐静脉内。输血完成后,静脉输入1 ml生理盐水,取1 ml血,弃去后再抽取1 ml血,重新测定红细胞压积(目标为40%~50%)。
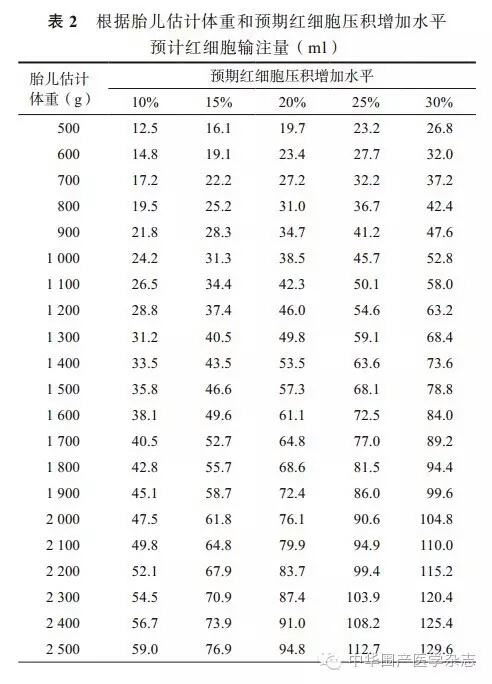
4.手术并发症:研究表明,与操作相关的并发症总体发生率为3.1%,其中胎死宫内为0.9%,新生儿病死率为0.7%,急诊剖宫产率为2.0%,感染率为0.3%(均提示为大肠杆菌),未足月胎膜早破为0.1%;无水肿儿的的操作相关的并发症比例为2.9%(17/583),而水肿儿的比例为3.8%(6/157)(P=0.60),无水肿儿的围产期病死率为1.4%(8/583),而水肿儿的病死率为2.5%(4/157)(P=0.29);<20孕周接受手术者,发生操作相关胎儿丢失的比例最高(5.6%)[21]。操作相关胎儿并发症通常与脐带局部并发症相关,如较大血肿压迫脐静脉,难以避免的脐动脉穿刺导致的动脉痉挛,或由于大量出血导致胎儿失血过多。短暂胎儿心动过缓是宫内输血最常见的并发症,可能是由于误穿刺脐动脉导致,常可逆。其他潜在并发症包括胎儿脑损伤,可能与血管内容量变化、血流动力学和/或黏度相关;胎动易使胎儿受穿刺针损伤;因胎盘大静脉撕裂导致出血;以及母胎输血可能会增加母体抗体滴度导致再次妊娠时Rh溶血加重等。
5.术后处理:目前尚无证据支持行宫内输血同时需给予预防性抗生素。术后可根据孕周、宫缩情况决定是否继续应用保胎药物。
四、胎儿宫内输血后的孕期监测、终止妊娠时机与新生儿预后
1.胎儿宫内输血后的孕期监测:对于因胎儿严重贫血首次实施宫内输血者,如孕周偏小,需要二次输血的概率将明显增加。输血后因同种免疫仍存在且继续,胎儿血红蛋白及红细胞压积逐渐下降,估计血红蛋白平均每天下降4 g/L,红细胞压积每天下降约1%[5]。宫内输血术后,应定期监测胎儿MCA-PSV。对于监测频率目前尚无明确建议,但需行介入性操作的MCA-PSV阈值为1.69 MoM[5],同时强调二次输血时机应个体化,根据胎儿状况、首次输血后胎儿红细胞压积、预计红细胞压积下降水平,而不能仅依靠胎儿MCA-PSV阈值决定。有研究表明,MCA-PSV预测重度贫血的敏感度为100%,假阳性率为6%[22]。
2.胎儿宫内输血后终止妊娠的时机:目前对于胎儿贫血行宫内输血后何时应该终止妊娠,尚无定论。一般认为,应权衡胎死宫内风险、胎儿贫血预后、再次宫内输血风险和早产风险等。所以目前一般认为,34~35孕周后不建议行宫内输血。胎儿宫内输血后希望分娩胎儿贫血程度不重,分娩时准备和新生儿科积极配合与产前处理同样重要。
3.新生儿预后:应用宫内输血可使严重贫血围产儿病死率降至10%以下[5]。新生儿娩出后因溶血导致高胆红素血症,治疗原则主要是预防核黄疸,主要手段包括光疗和输血等。近期并发症包括新生儿贫血、血小板减少、肝内胆汁淤积和呼吸系统疾病。新生儿肝内胆汁淤积与结合胆红素升高相关。但新生儿溶血性疾病导致肝内胆汁淤积的病因尚不明确,可能与宫内及生后多次输血导致肝内铁负荷加重有关。多次宫内输血新生儿多面临网织红细胞缺乏,这是由于多次输血导致新生儿红细胞主要由成人血红蛋白组成,故在出生后最初几周内往往由于贫血需要输血治疗。有研究回顾了1990年至2010年因红细胞同种免疫行宫内输血者,共284例次、84例孕妇,总生存率为91.8%(78/85),24%(19/80)的新生儿在34孕周前分娩,新生儿住院天数平均为8(0~64)d;97.5%(78/80)需要光疗,61.2%(49/80)的新生儿进行了输血治疗,28.8%(23/80)需要再次输血[23]。
宫内输血后长期随访研究(long-term follow-up after intrauterine transfusions,LOTUS)是目前最大规模的关于宫内输血术后儿童神经系统发育的研究[24]。该研究中,共有291例儿童(年龄2~17岁)在1988年至2008年间因红细胞同种免疫接受了宫内输血,其中80%(233/291)是由于Rh(D)溶血,12%(36/291)由于Kell血型系统,5%(15/291)由于Rh c抗原,其他同种免疫占2%(6/291)。新生儿总存活率为90%(407/451),严重的先天异常占1%(3/407),发生神经发育损害(脑性瘫痪、严重发育迟缓、耳聋或视力障碍)的比例为4.8%(14/291),术前的危险因素、严重的水肿与神经发育损害相关[24]。
因此,临床上应重视母胎Rh阴性血型不合的孕期监测与处理。建议首次产检时即行孕妇血型监测,如为Rh阴性,建议行胎儿父亲血型检测,如为Rh阴性则孕期无需特殊处理,如为Rh阳性,告知胎儿在孕期有发生血型不合导致胎儿贫血、心力衰竭、水肿,甚至死胎、新生儿死亡等严重后果的可能性。建议所有Rh阴性孕妇首次就诊时,均应行间接Coomb's试验,筛查有无抗D抗体。如果抗体超过临界值者,则孕妇已经致敏,再次致敏者抗体滴度不足以评估病情程度及胎儿溶血风险,故孕期不建议检查抗体滴度,16孕周以后建议超声监测胎儿MCA-PSV。对于抗体阴性者,孕期只需定期监测抗体水平,如滴度超过临界值,建议监测胎儿MCA-PSV。MCA-PSV超过1.5 MoM者,建议同时请不同的医师进行测量,如测量值相一致,建议行脐静脉穿刺术,同时做好宫内输血的准备,并做好输血后孕期胎儿的监测。目前认为宫内输血是一种相对安全的操作,可以明确改善胎儿贫血的状况,提高新生儿结局。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号