【摘要】
目的 探讨不同的脱颗粒细胞与ICSI时间间隔对新鲜周期ICSI-ET妊娠结局的影响。
方法 回顾性分析了邢台不孕不育专科医院生殖中心2017年1月至2018年12月行新鲜周期ICSI-ET患者的临床资料,共371个周期。根据脱颗粒细胞与ICSI时间间隔分为三组:A组(64个周期):t≤1h组,B组(133个周期):1h<t≤2h组。C组(174个周期)t>2h组。分别比较不同的脱颗粒细胞与ICSI时间间隔对妊娠结局的影响。
结果 三组的基本资料比较均无显著性差异(P>0.05),三组的2PN受精率、2PN卵裂率、可用胚胎率比较均无显著性差异(P>0.05)。A组和B组的妊娠率无显著差异,但两组和C组比较均有显著差异(P>0.05);A组的种植率均显著高于B组和C组(P<0.05),但B组和C组比较无显著性差异(P>0.05);三组的流产率比较无显著性差异(P>0.05)。
结论 卵母细胞脱颗粒后2h内行ICSI能够获得较好的妊娠结局,但1h内操作妊娠结局最佳。
【关键词】 脱颗粒细胞;卵胞浆内单精子注射;临床妊娠率;种植率
在辅助生殖技术中,卵胞浆内单精子注射约占30%左右,在解决男性不育方面显示了极大的优势,受精率较高,能够有效地预防和挽救常规体外受精完全受精失败的发生[1]。在ICSI操作过程中,卵母细胞获取后,进行一段时间的预培养,诱发卵母细胞质或核的成熟,颗粒细胞对卵母细胞的成熟有重要的调控作用,因此脱颗粒细胞时间对于受精及胚胎发育至关重要[2]。目前关于ICSI时间的研究主要集中在HCG后ICSI时间以及取卵后ICSI时间等方面,而国内外对脱颗粒细胞与ICSI时间间隔很少有报道,本文在HCG后36.5h取卵,在HCG后40~42h内行ICSI,将脱颗粒细胞时间与ICSI时间间隔分为三个阶段(≤1h、1h<t≤2h、t>2h,比较不同阶段的胚胎发育情况及临床妊娠情况,为临床ICSI操作提供参考。
资料与方法
一、研究对象与分组
回顾性分析邢台不孕不育专科医院生殖中心2017年1月至2018年12月行ICSI-ET患者的临床资料,共371个周期。纳入标准:(1)首次ICSI周期;(2)采用黄体期长方案降促排卵(3)女方年龄≤38岁。排除标准:(1)卵巢功能减退、卵巢早衰;(2)获卵数≤5个(3)促排卵周期≥2个;(4)经皮附睾精子抽吸术、经皮睾丸精子抽吸术来源的精子。
所有患者均在HCG后36.5h取卵,在HCG后40~42h内行ICSI,根据脱颗粒细胞与ICSI时间间隔分为三组:A组(64个周期):t≤1h组,B组(133个周期):1h<t≤2h组。C组(174个周期)t>2h组。分别比较三组两种移植策略对妊娠结局的影响。
二、研究方法
1. 卵母细胞获取
所有患者均采用常规长方案,于月经周期的黄体中期开始降调节,达到降调标准后,加用促性腺激素,B超监测卵泡发育情况,测定血激素水平,根据监测结果调整用药剂量。当B超监测卵泡直径达到标准,注射HCG(珠海丽珠制药)5 000~10 000 U,36.5 h经阴道超声引导下穿刺取卵。卵丘复合物取出后置于卵子洗涤液中充分洗涤2遍后置三气培养箱(37℃、6%CO2、5%O2)中培养。
2.脱颗粒细胞
卵母细胞培养一段时间后,将卵母细胞置于稀释好的透明质酸酶中,轻柔吹打数次使大部分颗粒细胞脱落,作用时间少于1分钟,然后将卵子置于培养液中,换用其他合适内径的巴斯德吸管继续吹打,去除颗粒细胞,反复洗涤数次后置于培养液中三气培养箱(37℃、6%CO2、5%O2)中继续培养。
3.ICSI受精
培养一段时间后,挑选有明显第一极体的卵母细胞进行显微注射,注射用仪器以及培养环境均相同,将行精子注射的卵母细胞充分洗涤后,转移至平衡过夜的G-1培养液(vitrolife,瑞典)中,置于三气培养箱(37℃、6%CO2、5%O2)中继续培养。
4.胚胎培养与胚胎移植
次日早晨于倒置显微镜下观察卵母细胞受精情况,有原核(PN)为受精:2PN为正常受精;继续培养24h和48h观察胚胎,评估胚胎质量,记录卵裂情况。取卵后第三天或第五天选择 1-3 个质量较好的胚胎移植,其余可利用胚胎行冷冻保存。胚胎移植后行常规黄体支持,移植后14 d测血β-HCG水平,阳性者于第28日行阴道B超检查,见到妊娠囊者确定为临床妊娠。
5. 本中心可用胚胎评估标准:根据卵裂球数目、形态、碎片情况对卵裂期胚胎进行评分:1级:卵裂球大小均匀,形态规则,胞质均匀清晰,无碎片或<10%;2级:卵裂球大小均匀或略不均匀,形态欠规则,无碎片或10%~20%;3级:卵裂球大小不均,形态欠规则,碎片20%~50%;4级:卵裂球大小严重不均,碎片>50%。
卵裂胚可用胚胎标准:细胞数≥6个,评分为1级、2级和3级。D3优质胚胎标准[3]:D1为正常受精(2PN),6个≤细胞数≤10个,评分为1级和2级。
可用囊胚标准:囊胚至少发育到囊胚腔完全扩张充满整个胚胎;内细胞团细胞数目多而均匀,连接紧密或细胞数目相对较少或连接分散;滋养层细胞数目少或仅有少量大细胞即可。优质囊胚标准[3]:D1为2PN,囊胚腔及内细胞团达到可用囊胚标准,滋养层细胞数目多,大小均匀,呈镰形,或细胞数目较多,但有大细胞或不均匀。
6. 观察指标:2PN受精率=2PN数/MⅡ卵子数;2PN卵裂率=2PN卵裂数/2PN数;可用胚胎率=可用胚胎数/卵裂数;种植率=B超下见到孕囊数/移植胚胎数×100%;妊娠率=妊娠患者数/移植患者数×100%;流产率=流产患者数/妊娠患者数×100%。
三、统计学分析
采用SAS 9.2统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,正态分布者,组间比较采用独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。
结 果
一、患者基本情况分析
三组患者的年龄、不孕年限、基础激素值、HCG日激素值、胚胎移植数量以及子宫内膜厚度等比较均无显著性差异(P>0.05)。
二、三组的妊娠结局比较
三组的2PN受精率、2PN卵裂率、可用胚胎率比较均无显著性差异(P>0.05)。A组和B组的妊娠率无显著差异,但两组和C组比较均有显著差异(P>0.05);A组的种植率均显著高于B组和C组(P<0.05),但B组和C组比较无显著性差异(P>0.05);三组的流产率比较无显著性差异(P>0.05)。详见表1。
表1 三组胚胎情况及妊娠结局比较 (%)
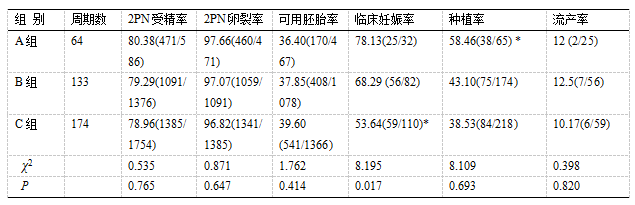
注:C组与A、B组比较,*P<0.05
A组与B、C组比较,*P<0.05
讨 论
目前,辅助生殖实验室的各项技术已经十分成熟,胚胎学家越来越关注操作细节,ICSI的各时间节点,如注射HCG后ICSI时间,取卵后ICSI时间以及脱颗粒细胞后ICSI时间等目前尚无明确的定论。注射HCG后卵母细胞受精时间是影响ICSI妊娠结局的重要因素,授精过早或过晚均会影响到妊娠结局[4]。殷宝莉等报道注射HCG 后40~42h后行ICSI可获得较好的妊娠结局[5]。马龙等研究表明注射HCG后38~42h后ICSI授精的周期妊娠率和种植率均显著高于HCG注射42h后的周期[6]。因此本研究HCG后40~42h 行ICSI授精,HCG后取卵时间固定,比较不同脱颗粒细胞后ICSI时间对胚胎发育及妊娠结局的影响。
卵母细胞周围包裹着的大量颗粒细胞,参与构成卵母细胞发育的微环境。两者为结构和功能上的统一整体,涉及复杂的双向信号传导系统和分子水平机制,颗粒细胞对卵母细胞的发育成熟有重要的作用,同时调控受精及胚胎发育过程,大量研究表明颗粒细胞的一些基因能够预测胚胎发育潜能及临床妊娠结局[7]。单卵母细胞的卵丘细胞的GDF-9与BMP-15mRNA能够评价卵母细胞的质量和预测卵母细胞发育潜能[8]。任文娟等[9]将未成熟卵母细胞与卵丘颗粒细胞共培养能够促使卵子体外成熟,从而增加优质胚胎数,改善妊娠结局,减少周期取消率。李洋[10]研究结果表明,将M1期和GV期卵母细胞与颗粒细胞共同培养后能够增加总成熟率,M1期来源获得的优质胚胎率较高,表明卵丘颗粒细胞共培养能够促进卵母细胞的核质同步化。
目前辅助生殖技术使用控制性超促排卵在非生理状态下募集较多的卵泡发育,可能会影响卵子的质量,损害线粒体功能,影响细胞骨架[11],从而导致卵母细胞的核-质发育不同步[12],其核的成熟先于质的成熟。而脱颗粒前的预培养可能帮助 MII 卵母细胞胞质的成熟。Rienzi 等[13]研究表明,取卵后3h以上脱颗粒有利于提高受精率及优胚率。ICSI前预培养时间过短可能不利于卵母细胞的成熟,从而影响其发育潜能。Catherine 等研究认为脱颗粒前的预培养不会影响到核成熟,但颗粒细胞的存在会促进胞质的成熟,有利于卵子内细胞器的发育,胞浆成熟的卵子线粒体能量供应充足,从而促进胚胎的发育,获得良好的妊娠结局[14]。本研究HCG后行ICSI授精时间和HCG后取卵时间固定,即取卵距ICSI受精时间固定,比较三个不同脱颗粒细胞与ICSI时间(t≤1h组;1h<t≤2h组和t>2h组)对临床结局的影响,结果表明脱颗粒细胞与ICSI时间间隔越短,移植后临床妊娠率和种植率越高,其中1h<t≤2h组和t≤1h组取得较高的妊娠率和种植率,t>2h组相对较低。因此卵母细胞脱颗粒后1h内操作妊娠结局最佳,但如果由于时间及人力等现实原因无法实现,最好在卵母细胞脱颗粒后2h内行ICSI。从以上结果可知,取卵后不宜过早去除颗粒细胞,颗粒细胞的存在有利于卵母细胞的进一步成熟,从而有利于获得良好的妊娠结局。宫立国等[15]研究与本文研究结果一致,拆卵后30min行ICSI囊胚形成率及妊娠率高于3-4h组。Cotti等[16]研究结果为脱颗粒距ICSI时间<1h组的优胚率、种植率与妊娠率均显著高于1-3h组,因此脱颗粒后应在较短时间内行ICSI会获得较好的妊娠结局。Catherine等[17]研究结果表明随着脱颗粒至 ICSI 注射时间的延长,受精率逐渐下降,建议在脱颗粒后立即行ICSI精子注射。但拆卵后卵母细胞培养时间不宜过短,拆卵过程中的的透明质酸酶化学作用和机械吹吸动作可能会给卵膜带来一定程度的损伤,拆卵后应继续培养一段时间再行ICSI,我们认为拆卵后至少培养10min后行ICSI受精较好。
综上所述,与卵母细胞脱颗粒后>2h比,卵母细胞脱颗粒后2h内行ICSI能够获得较好的妊娠结局,但1h内操作妊娠结局最佳。但本研究由于数据量较少,仍需要大量前瞻性研究进行验证。
【参 考 文 献】
[1]1aChiamchanya C,To rudom P, Gamnarai N. Comparative study of intracytoplasmic sperm injection and in vitro fertilization with high insemination concentration in sibling oocytes in the treatment of unexplained infertility[J]. J Vled Assoc Thai,2008,91(8):1155-1160.
[2]Vanderhyden BC, Armstrong DT. Role of cumulus cells and serum on the in vitro maturation, fertilization,and subsequent development of rat oocytes, fertilization and subsequent development of rat oocytes[J].Biol Reprod,1989,40(4):720-728.
[3]陶林林,李国臻,杨志伟,等.冻融胚胎体外培养时间对临床结局的影响[J].生殖医学杂志,2017,26:1250-1253.
[4]倪佳黄,静柳,胜贤等. HCG后不同时间短时授精对常规体外受精妊娠结局的影响[J]. 中国优生与遗传杂志,2014,22: 117-118.
[5]殷宝莉,贾楠,姜李乐. 注射HCG后不同授精时间对ICSI助孕临床结局的影响[J]. 生殖医学杂志,2016,25:1059-1063.
[6]马龙,钱晓乔,蔡令波. 显微穿刺时机对卵胞浆内单精子注射临床结局的影响[J]. 生殖医学杂志,2013,22:39-42.
[7]叶娜,董晓英,李冬华.卵巢早衰的颗粒细胞凋亡机制研究进展[J],首都医科大学学报,2014,35(3):379-383
[8]单卵母细胞对应的卵丘颗粒细胞中生长分化因子-9和骨形成蛋白-15的表达水平与胚胎发育潜能的研究[J]. 中国优生与遗传杂志,2018,26:116-120、
[9]任文娟,惠董娜,雷鑫等.卵丘颗粒细胞复合体在卵母细胞体外成熟和胚胎发育中的作用[J]. 中国优生与遗传杂志,2018,26:113-110.
[10]李 洋,等. 体外受精- 胚胎移植周期未成熟卵体外成熟培养的临床价值[J]. 生殖医学杂志,2017,26(12):1212-1216.
[11]戴蜜蜜,葛红山,吕杰强.控制性超排卵和体外成熟培养对卵子线粒体膜电位及细胞骨架的影响[J] 实用医学杂志,2016,32(16):2625-2628.
[12]蔡娇娇,陆文昊,杨欢利等.卵母细胞质量的影响因素[J].中国计划生育学杂志,2018,26:70-73
[13]Rienzi L,Ubaldi F,Anniballo R,et al.Preincubation of human oocytes may improve fertilization and embryo quality after intracytoplasmic sperm injection[J],Hum Reprod,1998,13(4):1014-1019
[14]Patrat C,Kaffel A,Delaroche L,et al.Optimal timing for oocyte denudation
and intracytoplasmic sperm Injection [J].Obstet Gynecol Int,
2012,2012(2012):1-7
[15]宫立国,王维华,Inderbir Gill. ICSI操作中拆卵时间对胚胎质量及妊娠结局的影响[J].中国优生与遗传杂志,2011,19:113-114.
[16]Alikani M,Calderon G,Tomkin G,et al.Cleavage anomalies in early human embryos and survival after prolonged culture in vitro[J].Hum Reprod, 2000,15(12):26634-2643.
[17]Catherine Patrat Aida Kaffel,Lucie Delaroche, et al. Optimal Timing for Oocyte Denudation and Intracy toplasmic Sp erm Injection[J]. Obstetrics and Gynecology International, 2012,7:1-2
陶林林:邢台不孕不育专科医院生殖实验室技术员,检验师;硕士研究生,毕业于生物科学本科专业。
从事生殖实验室工作多年,擅长实验室质量控制、IVF-ET、ICSI操作、胚胎移植、冷冻等多种实验室技术。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号