1型糖尿病视网膜病变 (DR) 合并妊娠, 对母儿的危害极大, 可增加各种并发症的发生风险, 为糖尿病妇女妊娠的相对禁忌证, 但如何通过孕前、孕期、 产褥期的规范管理, 降低母儿并发症, 是孕期管理的重点。本文报道1例成功案例并对国内外相关文献进行综述。
1 病历摘要
患者32岁, G1P0。因发现糖尿病24年, 停经36周于2015-10-20入院待产。末次月经2015-02-10, 预产期2015-11-17, 停经35 d测尿hCG阳性; 停经6周行阴道彩超确诊宫内早孕; 停经12周余出现中度恶心、 呕吐等早孕反应, 查血糖2.9 mmol/L,至当地医院营养支持治疗, 好转后出院; 孕期未行胎儿颈项透明层厚度 (NT) 检查。孕18+3周行唐氏筛查 (唐筛) 示21-三体综合征 “临界风险”, 孕18+5周行无创产前基因诊断示 “低风险”; 孕26周行Ⅲ级彩超未见异常。孕前3个月至孕26周胰岛素泵入用量三餐前5 U, 基础量14 U/d, 自测微量血糖,三餐前波动在5.1~8.0 mmol/L, 三餐后2 h血糖波动在8.5~10.0 mmol/L; 孕26周余因频繁呕吐伴乏力、 眩晕等不适入当地医院就诊, 测血糖1.9 mmol/L,血压 (BP) 162/90 mmHg (1 mmHg=0.133 kPa), 休息后复测血压波动于110~134/70~80 mmHg。查尿蛋白+, 尿酮体++++, 血气分析未见异常。考虑 “轻度子痫前期; 糖尿病合并妊娠; 妊娠剧吐; 饥饿性酮症”。当地医院建议患者终止妊娠, 患者及家属拒绝并要求转入本院。予以胰岛素泵控糖治疗,营养支持, 胰岛素用量为三餐前6-6-6 U, 基础量15 U/d, 病情渐稳定, 餐前血糖波动在 7.8~10.2 mmol/L, 餐后2 h血糖波动在4.4~9.1 mmol/L,糖化血红蛋白 (HbA1c) 6.0%; 查动态血糖监测波动于 3.0~13.9 mmol/L, 动态血压波动于 100~118/81~90 mmHg, 反复查酮体、 尿蛋白阴性, 出院并本院门诊每周产检。孕30周始调整胰岛素三餐前用量为7-5-5 U, 基础量每日分8个时间段泵入, 共15.4 U/d, 至孕36周; 期间监测血糖, 三餐前血糖波动于 4.7~10.0 mmol/L, 三餐后 2 h 血糖波动于6.0~10.5 mmol/L, HbA1c 6.4%。孕36周始胰岛素用量减量为三餐前4-5-5 U, 基础量每日分5个时间段泵入, 共9 U/d, 直至分娩前; 期间监测血糖, 餐前血糖波动于3.3~10.1 mmol/L, 餐后2 h血糖波动于4.4~10.9mmol/L, 查HbA1c 6.2%。门诊产检血压正常, 尿蛋白、 尿酮体阴性, 整个孕期无烦渴、 多饮多尿等不适。
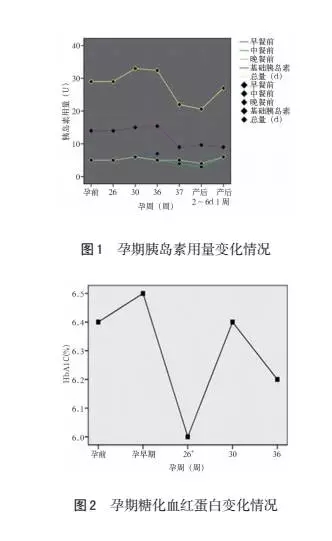
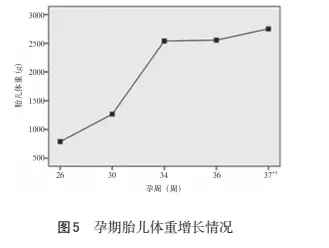
患者24年前 (8岁) 确诊为1型糖尿病, 开始使用皮下注射胰岛素治疗; 11年前开始出现视力下降、 视物模糊等, 10年前因糖尿病视网膜病变行右眼手术治疗, 术后右眼视力恢复良好, 持续半年后, 视力突然下降, 诊断为视网膜脱落, 其后双眼无法视物; 9年前开始使用胰岛素微泵治疗, 胰岛素用量为基础量14 U/d、 三餐前均为5 U, 此剂量一直用至孕前。孕前3个月复查HbA1c 6.4%。患者既往无其他特殊病史, 否认家族遗传史。入院体检: T 36℃, P 87 次/min, R18次/min,BP: 101/71 mmHg, 身高158 cm, 体重61.5 kg, 体重指数(BMI)22.8, 心肺听诊无异常, 双下肢水肿(+)。专科检查: 宫高33 cm, 腹围94 cm, 胎方位右骶前 (RSA), 未入盆, 胎心率14次/min, 未扪及宫缩。阴检: 宫颈居后, 质软, 宫颈管消退40%, 宫颈口未开, S=-3, 宫颈Bishop评分3分。骶骨中弧, 尾骨不翘, 坐骨棘Ⅰ度凸, 坐骨切迹可容三横指, 骶尾关节活动度好。骨盆未见狭窄征。入院诊断:(1) 妊娠合并糖尿病。(2) 糖尿病视网膜病变 (Ⅴ期)。(3) G1P0孕36周, 单活胎, 臀位。患者围产期胰岛素用量见图1, 糖化血红蛋白变化见图2, 肾功能变化见图3, 母儿体重增长情况见图4和图5。患者于孕36~37周夜间凌晨3: 00多次测血糖达11.1 mmol/L以上, 最高达14.9 mmol/L, 且血糖波动幅度较大, 多次复查血酮体波动范围在0.3~0.6 mmol/L; 查肾功能肌酐、 尿素以及尿酸呈上升趋势 (见图3), 不能排除发生糖尿病肾病和糖尿病酮症酸中毒的可能, 于孕37+1周在硬膜外麻醉下行子宫下段剖宫产术, 新生儿体重2750 g, Apgar评分10-10-10分, 转新生儿科护理。术后12 h进食, 予胰岛素餐前4-3-4 U, 基础量0.4 U/ (h·d) 泵入, 直至术后6 d; 患者术后餐前血糖波动于4.7~9.4 mmol/L, 餐后血糖波动于6.0~10.2 mmol/L, 术后恢复可, 于术后6 d腹部切口拆线并出院。

2 讨论
2.1 妊娠合并糖尿病的发生率及DR分期 妊娠合并糖尿病是产科常见的高危妊娠, 近年来发病率持续上升, 可分为孕前糖尿病(PGDM) 和妊娠期糖尿病 (GDM); 其中, PGDM又分为妊娠前患有1 型糖尿病(T1DM)或妊娠前患有 2 型糖尿病(T2DM) [1-2]。妊娠合并糖尿病中, GDM占90%左右, 而PGDM不足10%, PGDM中, 大部分是T1DM患者, 占PGDM中的7.5%左右[3] 。糖尿病微血管病变是发生在糖尿病患者中的特异性损害, 主要表现为微循环障碍、 微血管瘤形成和微血管基底膜增厚。常见的糖尿病微血管病变主要包括糖尿病肾病 (diabetic nephropathy, DN) 和糖尿病视网膜病变(diabetic retinopathy , DR), 与高血糖密切相关。DR是成年人后天失明的主要原因, 其发生发展与糖尿病病程长短密切相关; T1DM病程超过15年者, DR的发生率高达98%[4] 。根据国际眼科会议和美国眼科学会联合会议提出DR国际临床分类, 将DR分成5期:(1) 1期无明显视网膜病变。(2) 2期为轻度非增殖性DR, 仅有微动脉瘤。(3) 3期属于重度非增殖性DR, 病变介于2期和4期之间。(4) 4期为重度非增殖性DR合并以下3项的任意1项: ①4个象限都有20个以上的视网膜内出血灶。②2个象限有确定的静脉串珠。③1个以上象限发生视网膜微血管异常。④无增殖性视网膜病变体征。(5) 5期为增殖性DR, 存在1种或更多种病变 (新生血管、 玻璃体积血、 视网膜前出血等)。本例患者T1DM病程24年, 双眼视网膜已脱落, 双目失明, 已发展为DR的第5期。
2.2 DR与妊娠的相互影响
2.2.1 DR对母儿的影响 (1) 对孕妇的影响: 主要包括子痫前期、 酮症酸中毒、 感染等发生风险增加。PGDM孕期12%~15%会发生子痫前期, 发生风险是正常孕妇的4~5倍[3, 5-7] ; 糖尿病B级子痫前期发生率为11%~12%, C级增加至21%~22%, D级为21%~23%, 而F~R级可高达36%~52%[8] 。PGDM者在孕期有1%~3%会发生酮症酸中毒, 胎儿的死亡率达35%, 是导致糖尿病孕妇胎儿死亡的重要原因, 需警惕其发生[3, 5, 9] 。控制血糖和孕妇体重达标而又不出现低血糖, 可降低酮症酸中毒发生的概率。另外, PGDM者由于细胞免疫和体液免疫发生异常, 合并妊娠时更易发生各种感染, 常见的包括泌尿系、 生殖道感染等。(2) 对围产儿的影响: 主要包括流产、 胎儿畸形、 胎儿生长受限、 羊水过多、 早产、 巨大儿、 死胎、 新生儿低血糖症、 新生儿呼吸窘迫综合征、 新生儿黄疸、 低血镁、 低血钙、 围产儿死亡等发生率增加。PGDM者在妊娠期有6%~10%会发生胎儿先天畸形, 4.3%会发生自然流产, 其发生胎儿先天畸形的风险比未患糖尿病的孕妇高2~5倍[5, 10] 。HbA1c水平高低与胎儿畸形的发生率密切相关。有研究表明, 当HbA1c>10.1%时, PGDM孕妇孕期发生胎儿畸形率达20~25%[11], 15%会发生胎儿生长受限, 50%会因为母体或胎儿原因发生早产, 0.58%会发生死胎, 其中引起死胎一半的原因与高血糖有关[3] 。(3)远期影响: PGDM患者孕期或产后数年发生DN等其他微血管病变的概率增加, 约5%会在孕期或产后数年内发生糖尿病肾病, 尤其是孕期发生过子痫前期的孕妇[3]。除此之外, 其后代将来发生肥胖、 代谢综合征和糖尿病的风险也大大增加。
2.2.2 妊娠对DR的影响 妊娠可促进DR的发生发展。妊娠期间, 39%病程超过15年的糖尿病妇女会发生增殖性视网膜病变, 病程不足15年者增殖性视网膜病变的发生率为18%[12] 。本例患者属于糖尿病D级, 妊娠中期发生了轻度子痫前期, 严密控制其血糖、 血压、 尿蛋白并监测其变化, 使其渐趋平稳。随着孕周的进展, 肌酐、 尿素氮以及尿酸水平均在不断上升, 提示肾功能下降 (如图3所示), 因患者T1DM病史24年,同时合并妊娠, 不排除发生DN的可能。
2.3 孕期及围产期管理
2.3.1 孕前管理 对所有DR妇女, 计划妊娠前均应在内分泌科和产科进行全面的孕前咨询和检查, 包括血压、 眼底、 肾功能、 HbA1c、 心电图、 心肌酶等, 评估PGDM病情严重程度, 确定是否适合妊娠。对于DR患者应接受治疗后方可妊娠[13] ; 对孕前使用降糖药的患者最好在孕前3~6个月停用降糖药, 改用胰岛素控制血糖达到或接近正常水平后再妊娠; PGDM计划妊娠前应将血糖控制在: 空腹血糖<6.5 mmol/L, 餐后2 h血糖<8.5 mmol/L;HbA1c<6.5% ,(注 射 胰 岛 素 者 ,HbA1c 可 <7.0%); 如HbA1c>8.0%, 不建议妊娠, 血糖控制良好后方可妊娠[13-14] 。充分了解妊娠与PGDM间的相互影响及母儿可能的不良预后, 在孕期严密监测其发生和发展。本例患者有11年DR史, 经治疗后复发, 致视网膜脱落失明10余年, 一直在内分泌科和营养科医生的指导下进行饮食、 运动、 胰岛素调节血糖等综合治疗, 孕前3个月反复查HbA1c、 空腹和餐后2 h血糖均达标后计划妊娠, 为其孕期减少母儿并发症的发生打下了良好基础。
2.3.2 孕期管理 受孕后最初7周是胚胎发育关键时期, 此阶段孕妇高血糖可致严重结构畸形或自然流产的发生[3, 5, 10] 。早孕期间胰岛素用量与孕前变化不大, 但易发生厌食、 恶心、 呕吐等消化道反应症状, 若胰岛素用量未相应减少, 则易发生低血糖, 引起饥饿性酮症; 因此, 在此期间要严密监测血糖和酮体的变化, 及时调整胰岛素用量, 并嘱患者少食多餐, 进食容易消化的食物, 必要时静脉营养, 减轻胃肠道负担, 防止低血糖和饥饿性酮症的发生[3, 5] 。本例患者因早、 中孕期频繁发生消化道反应, 而胰岛素用量未相应减少, 从而导致了低血糖和饥饿性酮症。随着孕周的增加, 胎盘分泌的抗胰岛素激素逐渐增多, 胰岛素抵抗逐渐增强;胰岛素抵抗始于孕24~28周, 孕32~34周达到高峰, 而孕妇体内所需胰岛素量也相应的增加, 孕晚期可达孕前水平的140%左右[3] ; T1DM患者孕期胰岛素用量达高峰为孕32~33周[15]; 直至孕36周,胰岛素抵抗水平不再进一步增加, 但因胎儿生长、发育及活动所需能量增加, 需要从母体体内获取更多能量, 表现出孕妇体内血糖水平稍下降, 胰岛素用量需相应的稍微减少。如图1示: 本例患者早孕至26周胰岛素用量同孕前; 26周以后缓慢逐渐增加; 30~36周达最大量, 约达孕前水平的114%;36周以后逐渐减量; 但本例患者胰岛素总用量在整个孕期波动幅度不大, 可能由于患者长期使用胰岛素, 对胰岛素敏感性下降, 使胰岛素用量不易掌握, 应以血糖控制水平并结合每餐食物摄取热量为基础, 个体化使用胰岛素。
孕期应严格控制血糖水平并密切监测血糖变化, PGDM血糖控制目标为: 餐前、 睡前及夜间3.3~5.4 mmol/L, 餐后 2 h 血糖峰值 5.4~7.1 mmol/L,HbA1c尽可能控制在6.0%以下, 同时还要注意避免低血糖发生[16] 。HbA1c反映近2~3个月内血糖的控制水平, 是评价血糖控制良好与否的可靠指标, 与PGDM孕期多种并发症的发生密切相关。Miailhe等[17]通过一项巢式病例对照研究发现,T1DM合并妊娠者分娩前HbA1c水平在6.4%或以上与紧急剖宫产密切相关; 且整个孕期血糖水平控制良好会降低中晚期胎儿损害风险。Timar等[10] 报道, 孕晚期HbA1c水平与胎儿出生时的脐血中促红细胞生成素相关, 提示母亲高血糖是胎儿窘迫的一个重要因素。Gordin等[7]研究发现,T1DM患者HbA1c水平增高与子痫前期的发生有关, 并增加后期发展成DN的风险。因此, PGDM患者, 应在早、 中、 晚孕期分别测定1次HbA1c, 最好在整个孕期每隔1~2个月复查HbA1c, 以预测和预防胎儿窘迫、 DN以及子痫前期等并发症的发生。如图2示: 本例患者整个孕期HbA1c水平波动于6.0%~6.5%, 血糖总体控制水平尚可, 但血糖波动幅度较大, 需不断微调胰岛素用量, 可能因患者长期使用胰岛素, 对胰岛素敏感性降低所致。
此外, PGDM孕期体重管理非常关键。该例患者BMI 22.8, 属标准体重。根据2009年美国医学研究会 (IOM) 推荐, 孕期总体体重增长范围应为11.5~16 kg。孕早期由于胎儿对营养的吸收有限, 体重增加1~2 kg; 孕中、 晚期由于胎儿发育、 胎盘增重以及羊水量的增加, 这两期体重应各增加5~6 kg, 体重增长的平均率约为0.4 kg/周。本例患者早孕期体重减少, 中孕期体重共增加了1.5 kg, 平均0.15 kg/周, 整个早中孕期体重增长过少, 说明饮食营养摄入不足, 从而导致多次出现低血糖和饥饿性酮症; 孕晚期体重共增加了5 kg, 平均0.71 kg/周,体重增长稍快; 总体来看, 此患者整个孕期体重增长过少而不达标。但整个孕期胎儿体重增长尚可(如图5所示), 胎儿发育也正常; 与中晚孕期合理控制饮食、 适量运动及个体化调节胰岛素使用使得母体血糖控制总体水平达标有关。
另外, 妊娠可促进DR的发生发展。PGDM患者应在妊娠早、 中、 晚期3个阶段进行眼底检查, 密切监测眼底变化情况, 防止妊娠加重视网膜病变。此外, 还应定期监测肝酶、 24 h尿蛋白、 肾功能等实验室指标, 并完善心电图、 心脏彩超等检查,评估器官受累情况, 慎防子痫前期和DN的发生。
2.3.3 分娩期管理 妊娠合并DR的孕妇, 如果血糖控制良好, 不伴有其它母儿并发症, 可在严密母胎监护下38~39周再终止妊娠, 如出现母儿合并症, 须适时终止妊娠, 必要时进行促胎肺成熟[18] 。DR合并产科指征为选择性剖宫产手术的指征。围手术期将血糖控制在6~9 mmol/L较理想。本例患者糖尿病视网膜脱落致失明多年, 且血糖控制不稳定, 于孕36~37周凌晨多次测血糖达11.1 mmol/L以上, 最高达14.9 mmol/L, 且血糖波动幅度较大, 多次复查血酮体波动在0.3~0.6 mmol/L;查肌酐、 尿素氮以及尿酸呈上升趋势; 不排除发生DN和糖尿病酮症酸中毒的可能, 继续妊娠可能危及母儿生命, 妊娠达37周, 臀位, 胎儿发育已成熟, 阴道试产预计不能短期内结束分娩, 遂择期行剖宫产术。该患者围手术期血糖控制在6.2~8.9 mmol/L,较为理想。
2.3.4 产褥期管理 分娩后随着胎盘的娩出, 胎盘分泌的抗胰岛素物质迅速消失。胎盘娩出后数日内患者对胰岛素特别敏感, 胰岛素需要量迅速下降, 产后应密切监测血糖的变化, 血糖控制目标同孕前。在恢复正常饮食后, 胰岛素用量一般应减少至分娩前用量的40%~50%, 通常在产后1周内恢复至孕前用量[3, 5] 。提倡母乳喂养, 其对子代具有一定的保护作用。有文献报道[1] , 具有T1DM个人史或家族史的妇女可能是HLA-DR3和HLA-DR4基因的携带者, 应告知孕妇婴儿配方的牛乳可刺激抗胰岛B细胞抗体的产生, 可促进T1DM在儿童期的发生发展, 因此, 提倡母乳喂养。如果必须人工喂养, 推荐使用大豆类的乳制品。另外, 母乳喂养可使产妇血糖水平降低, 需要适当减少胰岛素的用量, 适应母乳喂养的需要, 注意防止低血糖的发生。本例患者产后2~6 d胰岛素总量减少至分娩前用量的94%, 产后1周胰岛素用量基本恢复至孕前水平, 产后继续鼓励其坚持母乳喂养。
综上所述, 妊娠期是T1DM合并DR患者的特殊生理时期, 可增加各种并发症的发生风险。T1DM合并DR患者应孕前3~6个月咨询, 评估风险, 告知T1DM合并DR对母儿的危害性, 制定个体化的合理饮食、 运动以及血糖控制计划, 嘱患者待血糖控制达标后再怀孕; 妊娠后, 由内分泌科、 产科、 营养科、 儿科等多学科合作, 严密监测母儿状况, 减少母儿并发症的发生, 提高新生儿存活率;产后内分泌科应密切随访T1DM合并DR患者血糖控制情况及其并发症的发生、 发展以及严重程度。本例患者通过孕前、 孕期、 产褥期的规范管理, 母儿均未出现严重并发症, 是T1DM合并DR妊娠并成功分娩的一个案例。
参考文献:略
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号