曹冬焱:卵巢组织冷冻对青春期前女性癌症患者保留生育功能的作用
年轻的癌症幸存者越来越多,在肿瘤治疗开始前应当考虑和讨论他们未来的生育能力和卵巢功能。对于因接受了癌症治疗而可能导致卵巢早衰(POI)和不育的高危患者,卵巢组织冷冻(OTC)是一种可以保留生育的方法,但是有创,且仍然属于实验阶段,在成为临床实践之前尚需解决一些伦理和知情方面的重要问题。本文这篇综述讨论了如何识别治疗后将发生卵巢早衰的高危患者,暨作为可安全施行OTC的适应征人群,并探讨了冷冻卵巢组织再植的适应征。
文中采用爱丁堡标准(表1)作为OTC的适应征人群,34例符合标准的患者中有20例经知情同意后在肿瘤治疗开始前接受了卵巢冷冻,但只有14名完成了治疗后的卵巢功能评估,6名发生了卵巢功能卵巢早衰(POI);而376名不符合标准者中,141例完成治疗后的卵巢功能评估,仅1例发生了POI。符合上述标准者与不符合标准者在肿瘤治疗结束后15年的累计POI发生率分别为35%和1%,因此爱丁堡标准可指导临床选择OTC患者。冷冻卵巢组织自体移植的指征包括恢复生育能力,获得激素分泌以及诱导青春期。文献中冷冻卵巢组织自体移植后成功获得活产儿者有6例。

文献引自:Wallace WHB,Kelsey TW, Anderson RA. Fertility preservation in pre-pubertal girls withcancer: the role of ovarian tissue cryopreservation. Fertil Steril.2016;105(1):6-12.
姜璇:预防化疗药物所致卵巢功能损害
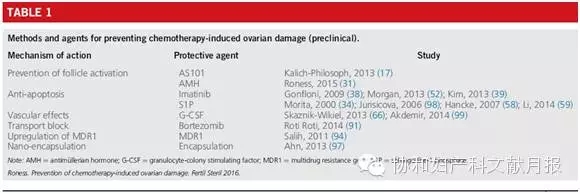
随着细胞毒性药物即化疗药物对卵巢影响机制的研究不断进展,通过药物预防或减少化疗药物对卵巢功能的损害,尤其是在化疗药物治疗肿瘤过程中保护卵巢功能的研究,也不断更新。相比于目前盛行的保留生育的各项辅助技术,预防卵巢损害和卵泡丢失的药物有一定的优势。本文针对化疗药物所致卵巢损害的药物预防方法进行综述,其中包括,作用于PI3K/PTEN/Akt卵泡激活通路、细胞凋亡通路、血管系统的药物,以及作用于其他潜在通路上的降低化疗所致卵泡毒性的药物。
不孕,继发性卵巢早衰(POF),卵巢功能不足(POI)是肿瘤化疗药物治疗的一项影响深远的长期后遗症。保护卵巢储备功能、避免不孕成为决定肿瘤患者生活质量、肿瘤患者和肿瘤医师共同面临的主要问题。目前保留女性肿瘤化疗患者生育能力的方法包括胚胎、卵细胞、卵巢组织冻存技术,不过这些技术受限于患者的年龄和婚姻状态,尤其不适用于青春期前儿童。另外,卵细胞冻存和胚胎冻存要求在特定时间段内取卵,需要持续用药,一般仅对卵巢早衰风险较高的患者采用,且要求患者具备一定的经济条件。肿瘤治疗结束后,冻存的卵巢组织移植回患者体内,也存在一定的风险,即:移植回的卵巢组织中存在癌细胞。在肿瘤化疗治疗过程中能够避免卵泡丢失的药物,其优势在于适用于任何年龄段,包括儿童,无需有创操作或其他辅助生育技术的支持。避免卵泡丢失、卵巢早衰,还能够预防卵巢早衰相关的其他内分泌问题包括,儿童正常进入青春期、无需额外使用药物,避免早绝经及早绝经相关健康风险等。
最具卵泡毒性的化疗药物包括,烷化剂类(环磷酰胺,白消安,达卡巴嗪),铂类(顺铂,卡铂),和紫衫烷类(紫杉醇)。烷化剂类和铂类作用机制相似,与DNA交联,引起DNA裂解,从而促进细胞凋亡。紫杉醇类是微管蛋白抑制剂,不同于破坏DNA的药物,紫杉醇通过Bax蛋白诱发细胞凋亡,蒽环类抗生素类化疗药阿霉素,通过插入阻断DNA复制导致双链DNA崩解,诱导正在发育中的卵泡的间质细胞和颗粒细胞凋亡。在卵细胞内部,蒽环类阿霉素诱导染色体片段化、胞浆片段化,形成凋亡小体,从而影响卵泡储备,其对卵巢功能不足(POI)的影响是低风险的。对于各种化疗药物作用机制的研究,每种药物对不同卵巢细胞类型的具体影响,化疗药物诱导卵巢损害和卵泡丢失的整体机制,不断提示我们药物预防卵巢损害的新靶点。本文综述了化疗诱导卵泡丢失的机制和通路、预防卵泡丢失的药物。见表1。
1. 卵泡激活通路
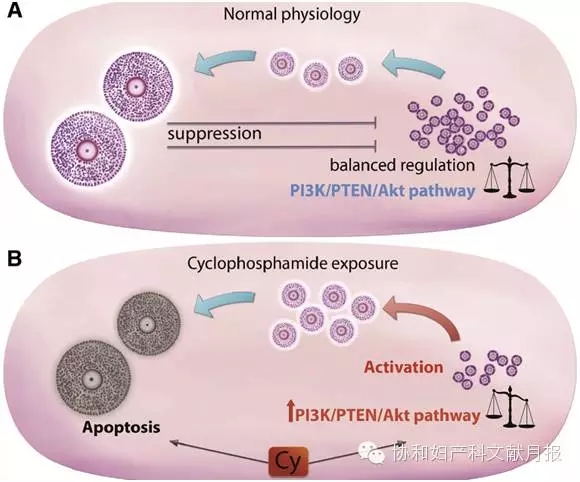
化疗诱导静息卵泡损害的最新观点认为,在体内,化疗药物如环磷酰胺和顺铂诱导静息卵泡生长发育,同时伴随大卵泡的凋亡。静息卵泡激活是通过激活PI3K/PTEN/Akt信号通路介导,该通路在静息卵泡中的作用在多个裸鼠敲除模型以及体外人卵巢皮质实验中已得到证实。化疗药物终止卵泡静息状态,诱导PI3K/PTEN/Akt信号通路激活,是通过直接作用于卵细胞和始基卵泡的前颗粒细胞实现的,或诱导大卵泡损伤而间接实现(见图1)。大卵泡损伤引起抗苗勒氏管激素分泌减少,对始基卵泡库的抑制作用减弱,诱发始基卵泡进入生长发育卵泡队列,此为始基卵泡激活和耗竭的机制。
图1. 环磷酰胺诱导静息卵泡激活和丢失。A.在正常卵泡发育过程中,始基卵泡受到PI3K/PTEN/Akt信号通路的调节,生长发育中的卵泡产生的抑制因子能够使大量始基卵泡处于静息状态,只有很少的卵泡进入生长发育。B.接触化疗药物后打破了这一稳态,PI3K/PTEN/Akt卵泡激活通路上调表达,生长发育卵泡凋亡,维持始基卵泡静息状态的抑制因子分泌减少,结果更多的始基卵泡募集、生长、发育、凋亡,导致卵泡库耗竭。
AS101
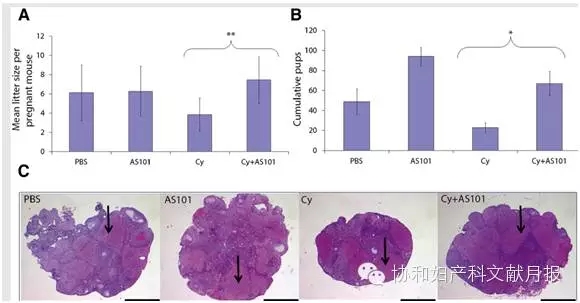
免疫调节剂AS101是一种作用于PI3K/PTEN/Akt信号通路的、非毒性有机碲化合物。小鼠体内用药实验发现,AS101通过调节PI3K/PTEN/Akt通路,环磷酰胺所致始基卵泡的丢失减少,发育中的卵泡颗粒细胞凋亡减少,改善了小鼠的生育结局(见图2)。不增加小鼠胎儿畸形,提示这些被“营救”的卵泡的功能完整性和遗传完整性并未受损。AS101不影响环磷酰胺在体内的抗肿瘤活性,与环磷酰胺合用还具有协同和增加的抗癌活性。
图2. 环磷酰胺治疗的小鼠联用AS101可改善生育结局。四组小鼠分别接受磷酸盐缓冲盐水,环磷酰胺(75mg/kg×4,每周注射一次),AS101(10mg),环磷酰胺+AS101。A.每组中每个妊娠小鼠的平均分娩量。B.在整个交配阶段每组中所有小鼠的分娩量。C.交配结束后取卵巢中线组织切片,HE染色显示黄体情况。
抗苗勒氏管激素(AMH)
AMH是由正在发育中的小卵泡颗粒细胞分泌、负向调节卵泡激活过程。AMH敲除的裸鼠实验以及卵巢组织体外培养,均发现,AMH抑制始基卵泡的募集和发育,维持静息卵泡库,AMH减少会引发始基卵泡库过度激活和耗竭。AMH的mRNA表达水平分析发现,小鼠在环磷酰胺处理后,其体内的AMH水平立即下降一半。将重组人AMH加入混有环磷酰胺代谢产物(磷酰氮芥)的离体培养系中,卵巢能够维持大量始基卵泡,一周之后始基卵泡丢失17%,而对照组丢失53%。AMH为内源性激素,副作用小。
2. 细胞凋亡通路
由DNA损伤诱发的细胞凋亡通路,是化疗和放疗所致卵巢损害中研究最为透彻的通路。细胞毒性药物所致细胞凋亡,特别容易发生在生长发育的卵泡中。在成熟卵细胞,凋亡是通过神经酰胺、Bax、激酶介导。
对静息始基卵泡的凋亡通路的研究发现,卵细胞核中的抑癌基因p53的同源体p63,尤其是p63异构体TAp63,是DNA损伤诱导细胞凋亡通路上的关键因子。当卵细胞暴露于放射线或化疗药物如顺铂后发生DNA损伤,p63通路上行表达,p63分子减少的小鼠卵细胞对放射线或顺铂引起的细胞凋亡作用发生耐药性。TAp63通过Bcl-2相关X蛋白(BAX)和Bcl-2同源拮抗抑制剂(BAK)促进细胞凋亡。凋亡激活是直接通过TAp73介导或通过p53凋亡上调蛋白(PUMA)和佛波酯诱导蛋白1(NOXA)的激活。PUMA和/或NOXA特异性耗竭的小鼠卵细胞,能够避免γ射线所致的细胞凋亡,孕育健康的子代,提示这些受保护的卵细胞能够进行DNA修复,后续功能正常。
凋亡通路上任何一个因子都能成为阻断卵巢细胞毒性作用的靶点。见图3。促进凋亡是许多种类化疗药物的关键抗癌作用,因此作用于凋亡通路上的药物,存在的问题是可能干扰化疗药物的疗效。阻断DNA受损的卵细胞凋亡,会使不具备DNA修复功能的生殖细胞存活,这些遗传受损的卵细胞会使后续妊娠流产率、胎儿死亡或胎儿畸形率增加。有研究发现,化疗后的患者再妊娠后,其胎儿畸形率及妊娠流产率均不增加,然而是否说明卵细胞未受损或进行了DNA修复,尚不可知。
图3. 卵细胞应对细胞毒性损伤的分子通路。DNA损伤激活c-Ab1,取决于损伤的类型和严重性,DNA修复、细胞增生及细胞死亡的平衡打破,中低水平c-Ab1的激活,通过Rad51促进DNA修复,高水平的c-Ab1则促进Tap63介导的细胞死亡。Tap63负责诱导凋亡家族成员PUMA和NOXA转录,接着与BAX/BAK结合,诱发凋亡。Tap63还能够增加PTEN水平,影响PTEN-PI3K卵泡激活通路,减少PIP3介导的AKT磷酸化,抑制增生。

伊马替尼
伊马替尼是竞争性酪氨酸激酶抑制剂,临床上用于治疗慢性髓性白血病,作为c-Ab1激酶抑制剂,能够预防顺铂所致始基卵泡丢失。c-Ab1酪氨酸激酶,作为“开关”,能够调节TAp63转录活性,以及顺铂和阿霉素作用后的凋亡通路。在有丝分裂和减数分裂的细胞中,c-Ab1还能够通过处理DNA裂解,维持基因组完整性。对小鼠同时使用伊马替尼和顺铂,能够减少始基卵泡丢失,改善其生育能力和生育结局。在一项研究中,通过c-Ab1的抑制剂GNF-2也证实了c-Ab1能够诱导卵细胞退化。体外培养卵巢的研究证实,伊马替尼降低了顺铂对卵泡的损害,Kim等人发现,伊马替尼能够抑制顺铂诱导凋亡上调因子的作用,在体外培养器官中发现其降低始基卵泡损害,并将其移植回肾包膜下,以评估其长期作用。由于c-Ab1在许多癌细胞系中介导顺铂活性,伊马替尼是否干扰顺铂的抗癌活性,还需要进一步评估。
1-磷酸鞘氨醇
S1P是神经酰胺凋亡通路抑制剂,移植了人卵巢组织的小鼠应用S1P后能够增加血管密度和血管生成,减少卵泡凋亡。在放射线暴露前应用S1P的小鼠,其卵泡数目的保护作用成剂量依赖性,大剂量给S1P后,始基卵泡和发育卵泡都得到了几乎完全保护。在S1P预处理后的大鼠/灵长类动物/移植人卵巢组织中的放射线相关始基卵泡损害都减少。S1P预处理也能够避免化疗相关卵泡丢失。有研究证实了S1P预处理的达卡巴嗪治疗后小鼠,其卵泡丢失减少,妊娠率增加。携带有人卵巢组织的小鼠,S1P预处理或同时给药,能够预防环磷酰胺和阿霉素所引起的卵泡凋亡。S1P处理离体的小鼠卵细胞,能够对抗阿霉素诱导的细胞凋亡。由于其血浆半衰期短,需要持续给药或注射至卵巢组织内部,这些给药方式限制了其临床应用,但另一方面也降低了其对化疗药物的治疗效果影响。雌性小鼠和猕猴在接受放射线之前接受S1P预处理,其后代未发现有显著异常,但未有针对化疗治疗的相似研究。
3. 血管效应
化疗诱导的卵泡丢失的另一机制是通过间接损伤了间质和血管系统,乳腺癌患者的卵巢血流成像显示,化疗后短时间内立即出现了卵巢血供的显著减少,在小鼠中,阿霉素给药后卵巢血容量急剧降低,小血管缩窄。既往接受过非不育剂量的联合化疗患者的卵巢组织检查发现,皮质间质血管增粗/玻璃样变,幼稚小血管杂乱增生,皮质包膜下局部纤维化。由于卵巢血供是终末动脉系统,这种类型的间质和血管损害是化疗损害始基卵泡储备的间接机制。
粒细胞集落刺激因子
G-CSF能够显著改善环磷酰胺/白消安和顺铂所致的始基卵泡损害,避免微血管损伤。在化疗的同时接受G-CSF治疗的小鼠,能够生育更多幼鼠。G-CSF对血管的保护作用减少了化疗相关血管损伤,改善局部缺血/纤维化/梗死等,而这些都是卵泡丢失的促发因素,G-CSF也有抗凋亡作用。尽管其具体机制还有待于进一步研究,但鉴于G-CSF在临床上广泛应用于化疗骨髓抑制副反应的治疗中,且不影响化疗治疗效果,因此有其优势。
4. 垂体性腺轴
促性腺激素释放激素类似物或激动剂(GnRHa)
GnRHa是第一有潜力预防化疗相关卵巢损害的药物,在化疗前和化疗中给GnRHa,通过降调节垂体性腺轴,诱导卵巢静息,从而降低性腺毒性。最初动物研究在恒河猴和小鼠身上证实了GnRHa的作用,但是接下来的几项临床试验颇具争议性。早期临床试验虽然证实了GnRHa的作用,但由于方法学的缺陷,结果有待商榷。表2列出了几项大规模的前瞻性随机对照试验的结果。

一项纳入281例乳腺癌患者的大型研究(74),同时应用GnRHa和化疗的患者(8%)在治疗后12个月发生卵巢早衰的比例明显低于单用化疗者(25%)。另外两项同样是乳腺癌患者的研究,一项纳入78例乳腺癌患者(75),一项纳入100例乳腺癌患者(76),分别是治疗后8个月和治疗后12个月评估,后者(76)未发现显著差异。前一项研究(75)同时还发现,69%的化疗同时联用GnRHa患者治疗后恢复正常卵巢功能,而仅26%的未联用GnRHa患者治疗后恢复正常卵巢功能。后一项研究(76)发现,在治疗后一年,两组的月经以及激素和超声指标均没有显著差异。其他三项小的临床试验,分别纳入了60例(77)、47例(78)、63例(79)乳腺癌患者,在治疗后三年,同样发现两组在卵巢早衰发生率方面无显著差异。一项纳入84例霍奇金淋巴瘤和非霍奇金淋巴瘤患者的临床试验(80),也发现在化疗后一年,卵巢早衰发生率两组无差异,而AMH水平在GnRHa组显著增高(1.4ng/ml和0.56ng/ml)。一项纳入了183例环磷酰胺和阿霉素治疗的乳腺癌患者的II期临床试验,GnRHa组在治疗后一年的卵巢早衰发生率显著降低(40%vs59%)(81)。早绝经预防临床试验(POEMS)共纳入257例激素受体阴性的乳腺癌患者,仅135例患者获得了完整的主要终点事件数据(早发型卵巢功能不足定义为治疗后2年月经稀少和FSH水平),GnRHa组卵巢早衰率明显降低(8%vs22%)(82),戈舍瑞林组的妊娠率更高(21%vs11%),但这项临床试验仅获得了一半患者的数据资料,且没有采取盲法。妊娠率的计算不是基于尝试妊娠的患者数目(尝试妊娠患者两组间的妊娠率没有差异)(83)。造成上述研究结果的不一致性原因是多方面的,包括化疗方案的种类和化疗时间长短不同,不同组织学类型的癌症,以及不同的结局指标。尤其是,患者接受的多是联合化疗,作用机制多样,因此很难阐释GnRHa的作用。另外,一个方法学上的难处是,尽管卵巢早衰是一个“有或无”的概念,而化疗对生育的影响通常是卵巢储备部分受损,引起生育能力低下或早绝经。这样的结局要求对卵巢储备更精细的检测比如AMH水平或窦卵泡计数。其他更长随访时间的临床试验/评估卵巢储备而不是卵巢功能的临床试验,正在进行中,或许能够帮我们搞清楚GnRHa在化疗过程中的保护作用。
由于人始基卵泡并不直接受促性腺激素作用,很难解释GnRHa影响卵泡储备的机制。有很多学说,包括认为GnRHa减少卵巢血流灌注,从而降低始基卵泡接触的化疗药物浓度;GnRHa能够上调抗凋亡分子如S1P的表达;最近有体外实验证实,环磷酰胺联合GnRHa能够维持AMH水平,抑制始基卵泡募集,避免静息卵泡过度激活。值得注意的是,近20多年的临床试验均证实GnRHa不影响化疗药物的疗效,GnRHa需要10天到3周的时间发挥其完全的卵巢抑制作用,因此在临床化疗过程中需持续GnRHa预处理。GnRHa长期用药的副作用包括绝经期症状和骨质疏松,而多数化疗药物也会引发绝经期症状和骨质疏松,因此GnRHa的应用还是应该更多权衡考虑患者卵巢早衰的风险。
5. 其他机制
干扰转运:硼替佐米
阿霉素必须与蛋白酶体结合并转运穿过细胞核膜才能够发挥DNA损伤的作用。高亲和力蛋白酶体抑制剂硼替佐米与阿霉素竞争结合蛋白酶体,从而阻止阿霉素在细胞核内聚集。硼替佐米在注射后的24小时内,能够阻止阿霉素在细胞核内聚集从而避免阿霉素诱导的DNA损伤和下游凋亡通路的激活。阿霉素和硼替佐米处理过的小鼠较单阿霉素处理过的小鼠产生的子代数量明显增加,硼替佐米在临床上已作为多发性骨髓瘤的靶向药物。
上调多重耐药基因(MDR1)
MDR1是和化疗药物代谢/清除/解毒相关的药物转运酶体,上调MDR1能够促进多种脂溶性抗癌药物的转运和流出,产生化疗耐药性。利用逆转录病毒转导上调颗粒细胞系的MDR1,从而减少化疗药物摄取,剂量依赖性地保护颗粒细胞免受阿霉素和紫杉醇的毒性作用,MDR1介导的颗粒细胞在紫杉醇或阿霉素治疗后的细胞存活能力增加,小鼠和人卵细胞的MDR转运体受抑制后引起细胞对环磷酰胺的毒性耐受性增加。该方法有一定的技术难度,因为MDR1存在于很多细胞,还需要保证化疗药物的疗效,因此要求特异性靶向作用于卵巢细胞上,逆转录病毒的应用也存在一定的风险,即病毒基因转移至生殖细胞或未来胎儿上。
药物包装
另一个研究方向是降低化疗药物的毒副作用,尤其是实体肿瘤,通过肿瘤靶向或非靶向的药物包装。一个成功的例子就是聚乙二醇化的脂质体包被的阿霉素,其心脏毒性减低,临床上用于卵巢癌和多发性骨髓瘤的治疗。最近有研究探索了纳米粒包裹的三氧化二砷(血液学恶性肿瘤治疗中用到的)能够降低血浆清除率,转运至肿瘤的药物比例增加,因此低剂量即可发挥抗癌活性,增加了实体瘤治疗疗效同时降低了卵巢毒性。研究表明纳米粒三氧化二砷的低峰值血浆浓度,限制了其在组织中的分布,从而降低了其对卵巢和卵泡功能的影响。另外一个优势是,药物包裹后减少了与其他药物的相互作用,尽管上述研究并没有具体探索,药物包裹后对化疗后的卵巢功能或储备的影响,但这一理论方法都值得进一步研究探索。
结论
化疗药物引发卵泡丢失的机制是多样的,不同的化疗药物作用于不同类型的卵巢细胞的特异性通路上,干扰任何一个环节都可能降低细胞毒性药物对卵巢的毒性作用。在化疗治疗的同时,药物保护卵巢是由于目前盛行的生育辅助技术的,因为药物预防适用于任何年龄段的妇女,不需要有创手术操作,不需要后续生育辅助技术支持,还能够避免早发型卵巢功能不足引起的其他内分泌问题。在上述介绍的所有方法中,GnRHa是唯一临床上正在应用的,在多种化疗方案中被证实无其他不良影响的药物。尽管上述这些药物的疗效还有待商榷,但大量证据表明它们对卵巢有一定的保护作用。多数药物正处于研究的早期阶段,从实验室到临床应用还有漫长的路要走,但这些初始研究不断更新着我们对于化疗药物损伤卵巢的机制的理解,使我们对于化疗所致不孕的预防能够做的越来越好。
文献引自:Roness H, KashiO, Meirow D. Prevention of chemotherapy-induced ovarian damage. Fertil Steril.2016;105(1):20-29.
(本文由北京协和医院妇产科编译)
本文为作者原创并授权妇产科在线发布,版权归原作者所有,欢迎转载,但请务必注明出处,否则将追究法律责任。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号