2014年8月的一期J Clin Oncol是有关老年肿瘤的综述专刊,非常难得。选择其中的13篇文章摘录如下。这些文章题目包括:
1.老年女性的卵巢癌和乳腺癌
2.癌症和衰老的生物学:细胞衰老相关的复杂性
3.癌症生存者问题:治疗后的生活及对老年人群的意义
4.老年人抗癌治疗的心脏问题
5.癌症系统治疗对认知的影响:对老年患者和生存者看护的意义
6.为罹患癌症的老年和衰弱成人设计治疗性的临床研究
7.将生物标记物整合入癌症和衰老研究中
8.国际老年肿瘤协会有关老年癌症患者评估的共识
9.老年肿瘤的个体医学
10.老年患者的放疗:临床决策的框架工作
11.老年癌症患者有关支持治疗的考虑
12.老年癌症患者有关手术的考虑
13.老年实体肿瘤患者的靶向治疗
具体笔记和摘录如下。
1.老年女性的卵巢癌和乳腺癌[1]
几乎一半的乳腺癌和卵巢癌患者诊断时年龄在65岁或更大年龄,其数目随着人群年龄和预期寿命的增加而不断增加。老年患者往往不同意得到标准的癌症治疗,更易发生高级别的毒副作用,死亡率更高。但生物年龄不应成为决策的唯一因素。功能性依赖、器官功能、合并症、药物学、社会支持、认知和(或)社会心理因素、总体生活期望和患者诊疗目标同样重要,应该在治疗前、治疗中不断评估。
由于缺少充分的筛查工具和非特异性症状,绝大部分卵巢癌女性是晚期患者(80%为III期)。老年女性死亡率要增加2倍。
手术选择
手术至关重要,因为残余肿瘤是生存的主要预后因素。老年患者手术患病率和死亡率风险增加。开腹探查即可进行诊断,如果可能可行微创操作。一旦确诊卵巢癌,手术治疗包括全子宫切除、双附件切除、大网膜切除、腹膜后淋巴结活检、横膈探查、腹膜活检和盆腹腔冲洗液检查。肿瘤细胞减灭术(CRS)后,最大的残留的未切除病灶直径在1 cm或以下的患者为“理想”的,更大病灶的情况为“亚理想的”。但是,没有大块病灶残留是手术目标,并预示着更好的预后。
手术训练和能力是影响CRS的主要因素。老年患者往往得不到确切的CRS治疗,绝大部分不会转诊到妇科肿瘤医师那里去。在一个系列报道中,80岁以上的患者大部分由普通外科医师(31%)和妇产科医师(29%)诊疗,提供的是不够积极的手术。在Surveillance, Epidemiology, and End Results研究中,因为不能切除、患病率及手术医师的决定,理想的CRS随着年龄增加而降低:60岁以下的为43.7%,60-79岁间29.5%,80岁以上21.7%。Nodin等发现75岁以上老年患者对于治愈性手术尝试的渴望和年轻患者是相同的。
严重的合并症常见于老年患者,对高手术患病率和死亡率的担心可能影响决策。一项研究中,年龄超过80岁的女性中83%患有严重的合并症,尽管88%的患者尝试CRS,只有25%达到了理想的肿瘤切除,38%出现了严重的并发症,13%在术后死亡,75%需要重症监护管理。尽管如此,Wright报道,对于各个期别的年轻患者和70岁以上的老年患者,理想的CRS和术后合并症发生率是类似的。目前正在研究术前老年学评估以辅助衡量手术风险和收益。
一线化疗方案
仔细考虑化疗剂量、方案和路径(静脉 vs. 腹腔内)以及时机(新辅助化疗 vs. 术后化疗)非常重要。生物年龄不应该成为用于决策唯一因素。功能性依赖,器官功能(听力,肾脏),合并症,多药治疗,社会支持,认知和(或)社会心理因素以及总体生活期望都同等重要,应该在治疗前、治疗中进行评估。重要的一线化疗研究及其老年患者的结果总结于表3。
表3. 卵巢癌治疗的一线方案。
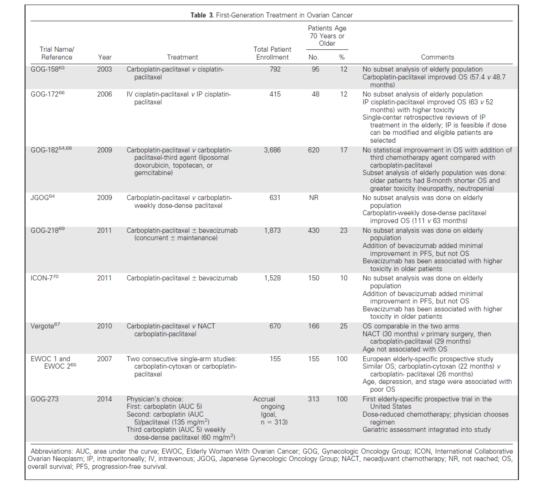
术后化疗
卵巢癌是化疗敏感的恶性肿瘤,一线化疗方案对于初治的生存有重要影响。目前标准的治疗是静脉卡铂(曲线下面积[AUC] 6)加上紫杉醇175 mg/m2(每三周一次)或紫杉醇80 mg/m2(每周一次)。术后老年患者化疗的耐受性研究很有限;绝大部分报道是回顾性研究或大型临床研究中的次级研究。改善一线方案耐受性的策略包括单剂卡铂化疗,小剂量周疗,以及减少基础剂量。目标在于减少毒性反应并保持疗效。
数项研究已经发现,能够耐受CRS的适合的老年女性可以(并且应该)接受标准的铂类-紫杉烷化疗。一项三级癌症中心接受了CRS的患者后续进行了化疗,不同年龄之间并没有结局上的差异。疾病分期、理想的CRS率、化疗周期数和化疗修正的情况在不同年龄组之间是相似的;在老年人群(大于65岁的患者)仅发现中位卡铂剂量(AUC)较低。临床完全缓解率(70% vs. 79%)、6个月的铂类敏感率(61% vs. 65%)和总体中位生存(52 vs. 55个月)在老年组和年轻组中是类似的。
但是,多中心的GOG-182研究中,620例老年患者(70岁或更大年龄)的分析显示,年龄是重要的危险因素。经过对主要预后因素进行调整后,老年患者一般状况更差,化疗完成率更低,毒性反应(粒细胞减少、神经炎)增加,8个月的总体生存率(OS)更短。为了强调结局的差异性,一项新近诊断III-IV期卵巢癌的老年女性(70岁或更大年龄)的大规模多中心前瞻性研究(GOG-273)正在进行中,接近完成(参见表3)。
老年学评估有助于肿瘤医师进行治疗选择。法国协作GINECO组(Groupe d’Investigateurs Nationaux pour l’Etude des Cancers de l’Ovaire et du Sein)进行了一项专门的老年女性卵巢癌(EWOC)项目。两项前瞻性研究用于评估70岁或更大年龄患者中铂类为基础的化疗方案的耐受性,以及老年学评估的应用。在第一项研究中(EWOC 1),72%的患者完成了六个周期的卡铂和环磷酰胺(每四周一次),毒性反应很小。老年学评估对于毒性反应有预后价值,特别是基础水平的抑郁,功能依赖和执行状态(American Society of Anesthesiologists评分≥ 2)。OS相关的独立的预后因素是抑郁,FIGO分期IV期,以及每天用药超过6种。在第二项研究中(EWOC 2),68%的患者完成了六个周期的卡铂(AUC 5)和紫杉醇175 mg/m2(每三周一次),和卡铂及环磷酰胺的方案相比,前者的血液学和神经毒性更大。不良预后的预测因素包括:高龄,基础状态的抑郁症状,紫杉醇的应用,以及FIGO分期IV期。
腹腔内化疗
对于III期理想CRS术后的卵巢癌患者,卡铂为基础的腹腔内(IP)化疗能够显著改善生存收益。技术上的困难(IP导管放置、合并症等)和增加的毒性(肾功能异常、神经病变和听力丧失)使得IP治疗不易接受,尤其是老年患者。在GOG-172中,只有48例女性(12%)超过70岁。无论什么年龄,由于毒性反应,不到50%的患者能够完成四个或更多周期的IP方案。两项回顾性研究报道了一组合适的老年患者人群中修正后的IP方案。他们发现老年患者不易完成所有的计划周期,更需要对剂量进行修正,但有相似的生存率和毒性反应。应该仔细地选择良好功能状态、充分肾脏和听力功能患者,并使之理解IP化疗更高毒性反应的可能性。
新辅助化疗
初始手术的一种替代治疗方案是新辅助化疗(NACT)后进行手术,主要目标是减少瘤负荷,增加成功、安全手术的可能性。一项大规模前瞻性随机化欧洲研究中,NACT和初次CRS的OS并没有差别。NACT的患者合并症更少一些。两项NACT的回顾性研究也有类似的发现,作者认为那些不太合适的、高合并症的老年患者手术患病率的风险更高,这些患者是NACT的恰当的候选者。Memorial Sloan-Kettering Cancer Center的研究组报道了他们的癌症人群中10%的患者因为期别高、合并症或高龄(超过85岁)而选择了NACT。选择NACT的患者OS较低,因此作者认为,如果可能的话,初次CRS仍应是治疗首选。需要建立指南明确哪些患者更适合进行NACT。Aletti等发现了一组高危女性,她们似乎并不适合初次手术,可能更适于应用NACT。危险因素包括:IV期疾病,较高的初始肿瘤负荷,不良的执行状态(American Society of Anesthesiologists评分≥3),不良的营养状态(白蛋白< 3.0 g/dL),以及高龄(75岁或更大年龄)。
复发性卵巢癌
化疗
大部分III期和IV期上皮性卵巢癌的女性都会复发,化疗在复发的情况下具有缓解作用。保证生活质量,避免毒性反应,保持功能独立对于治疗决策极端重要。铂类敏感(铂类治疗后无进展间期为6个月或更长时间)程度,癌症相关的症状,可测量疾病的出现,执行状态,合并症,患者诊疗的目标能够有助于治疗决策。在老年患者中,老年学工具可用于预测毒性反应并且指导恰当的药物治疗。
铂类敏感的复发
可考虑单剂卡铂用于无法评估的老年患者,因为它具有较好的耐受性和中度缓解率(22%到59%)。但是,鉴于双重药物对于OS的改善,绝大部分老年患者能够接受双药治疗。卡铂和紫杉醇、吉西他滨或脂质体阿霉素(doxil)都是标准的选择。对于老年患者,更常选择doxil或吉西他滨,因为它们较好耐受。CALYPSO研究(Caelyx Plus Carboplatin Versus Paclitaxel Plus Carboplatin in Patients With Epithelial Ovarian Cancer in Late Relapse)用于比较卡铂-doxil和卡铂-紫杉醇的非劣势性(noninferiority)。这项研究中,16%的患者为70岁或更大年龄。剂量设计在各年龄组间是相似的,但是老年患者和年轻患者相比,骨髓抑制更轻、神经病变更重。和紫杉醇组相比,doxil组有更好的无进展生存(11.3 vs. 9.4个月),卡铂过敏反应更低(5.6% vs. 18.8%)。最后,OCEANS研究(Study of Carboplatin and Gemcitabine Plus Bevacizumab in Patients With Ovary, Peritoneal, or Fallopian Tube Carcinoma)比较了吉西他滨-卡铂和贝伐单抗或安慰剂的疗效。贝伐单抗组无疾病进展生存更好(12.4 vs. 8.4个月),但是OS没有改善。大约35%的患者是65岁或更大年龄,但是她们也取得了相当的治疗收益。
铂类耐药疾病
单药治疗用于铂类耐药的疾病。NCCN指南列举了已知效果的药物。没有指南说明化疗的特定顺序。选择决定在于临床情景。应该考虑患者的偏好,合并症,功能状态,执行状态以及治疗的目标。肾功能不全患者的治疗指南已经发布。最常见的治疗包括周疗单药的紫杉醇、吉西他滨、拓扑替康和doxil。陪美曲塞、依托泊甙、依立替康、多西他赛、环磷酰胺、白蛋白结合紫杉醇(nab-paclitaxel)、奥沙利铂、长春瑞滨较少应用。贝伐单抗已经作为单剂或联合方案用于化疗。在老年患者,尚需关注血栓事件增加的风险。最后,激素治疗可用于如下情况的缓解治疗:患者没有症状也没有可测量病灶,CA125逐渐上升。选择应该基于毒性反应和患者风险(如他莫西芬的血栓风险,芳香化酶抑制剂引起的骨质疏松)。
复发后大量可选的化疗药物经常导致患者接受多重药物治疗。一项耐药疾病患者的研究发现,很多人直至生命的最后几个月仍在接受几乎没有临床益处的治疗。两种连续药物治疗后疾病仍然进展的话,应该考虑停止细胞毒性治疗,或至少开始讨论保守治疗。
总之,生物年龄不应成为决策的唯一因素。功能依赖、器官功能、合并症、多药使用、社会支持、认知和(或)社会心理因素、总体生活期望以及患者诊疗的目标同等重要,应在癌症治疗前和治疗中进行评估。
2.癌症和衰老的生物学:细胞衰老相关的复杂性[2]
在过去50年中,我们对于导致衰老和癌症的驱动力(包括平行的和对抗的力量)的理解已经取得重大进步。上世纪50年代开始出现大量有关衰老的理论,包括端粒生物学,老化理论(senescence)以及成人干细胞调节理论。这些假说得到了不断积累的实验证据的支持。这些观点提示突变的积聚可能是衰老和癌症的常见动力。另外,某些导致衰老的肿瘤抑制途径也符合拮抗性基因多效性学说(antagonist pleiotropy theory)。根据进化选择的一次性体细胞理论(disposable soma theory),衰老应该主要影响体细胞。在细胞水平,内源性和外源性途径都调节衰老和老化。但是,不断增加的证据支持如下假说,即这些驱动力可能受到修饰能量平衡的进化保守性途径调节。根据功能亢进理论,衰老是有利于年龄相关疾病和癌症的准程序(quasi-program),可以通过长寿途径(longevity pathways)的调节而被抑制。这篇综述总结了60年来有关衰老和癌症的假说及相关实验数据。
表1. 衰老的理论
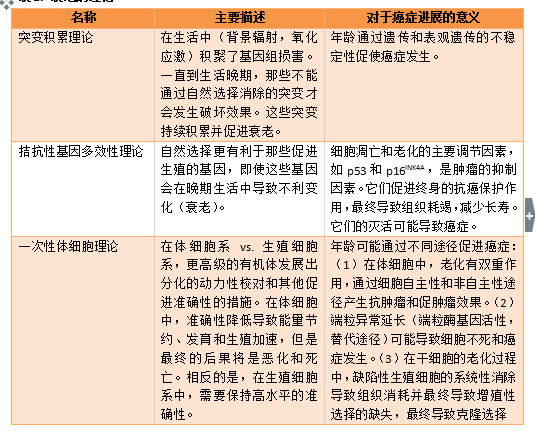

图1. 图示说明有关预防及增强衰老和癌症理论的不同地位。
3.癌症生存者问题:治疗后的生活及对老年人群的意义[3]
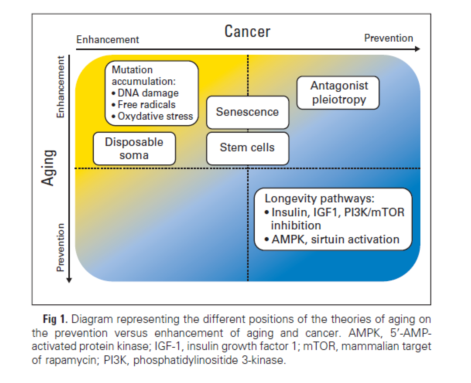
随着全国人口的老化和癌症患者预期生存的延长,到2020年,美国三分之二的癌症生存者年龄≥ 65岁(图1)。图2中可见绝大部老年患者在癌症诊断后生存≥ 5年。和年轻人相比,老年癌症生存者社会心理的适应更好。但同时,老年患者体格受限的风险更大,因为很有可能既往合并的健康问题会因为妥协的癌症护理而加重。80%的老年人有一种合并疾病,50%有两种或更多。与没有癌症的同龄人相比,即使以合并疾病种类进行控制,癌症生存者功能受限仍然更重。最近的数据发现了一些癌症及其治疗相关的晚期体格健康效应,这些情况对于老年人非常重要,包括:癌症相关的乏力,认知功能削弱,化疗导致的外周神经病变(特别是老年人可导致步态不稳)以及骨骼健康问题(见于以芳香化酶抑制剂治疗宫颈癌的绝经后女性,以及暴露于抑制雄激素治疗的前列腺癌患者)。现有证据表明锻炼干预对于老年生存者是安全和有效的,能够降低风险或控制功能衰退、骨骼健康及癌症相关的乏力。另外,观察性研究发现体格锻炼可能会延长生存。人群中大约有8%有> 1种癌症;在所有新发癌症的患者中,16%有癌症病史。而诊断癌症年龄≤ 19岁的年轻患者中,< 1%有癌症病史;在60-69岁,癌症史的比例为7%,而在70-79岁和≥ 80岁人群中比例分别为10%和12.1%。
作者从制度设计层面回顾了老年癌症生存者治疗后随访的现有模式以及相关指南,并讨论了未来研究的机会,非常细致和深入。我真是大开眼界。一些有关癌症生存者的总结和结论参见表1和表2。建设和传递“治疗总结”(treatment summaries,TSs)和“生存诊疗计划”(survivorship care plans,SCOs)对于所有生存者和初级保健管理者而言都非常重要。表3列出了可能有利于预后的TSs和SCPs的建议:从生存者知识、功能和健康,到医师对系统水平效率和费用节省的知识和行为。全美各地应用和传递TSs和SCOs的比例都非常低。表4列出了挑战和可能的解决方案。
图1. 1971-2008年按照年龄分组的估计的有癌症病史的患者数目,延伸至2030年。
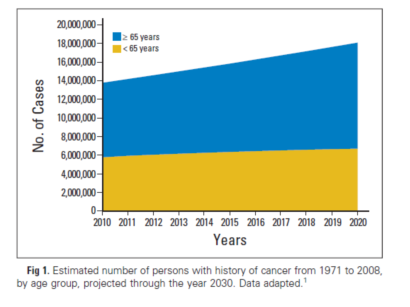
图2. 2014年年龄≥65岁的癌症生存者以年龄、性别和生存时间分组。
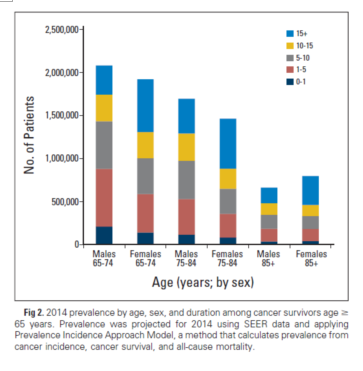
表1. 治疗总结的构成。


表2. 生存者诊疗计划的关键领域。

表3. 生存者诊疗计划评估的重要性:成功的指标。


表4. 影响生存治疗以及诊疗计划执行的障碍:基于社区的观点。ASCO,美国临床肿瘤协会;EHR,电子健康记录;NCCN,美国国立综合癌症网;RQRS,快速治疗报告系统。


4.老年人抗癌治疗的心脏问题[4]
癌症治疗,包括化疗和放疗,均会显著增加短期和长期的心血管功能效应。其心脏毒性可以是急性的,如ECG的改变,心律失常,缺血,以及心包炎和(或)心肌炎样综合征;心脏毒性也可以是慢性的,如心室功能失常。抗癌治疗也会导致间接效应,如血压改变,或导致代谢异常从而增加老年人心脏事件的风险。在观察性和临床研究数据中,蒽环类化疗导致的心脏毒性风险随着年龄增加而增加。但并不清楚这种年龄和心脏毒性的关系是否也见于新型治疗方案中。由于老年患者在临床研究中代表不足,且这一人群中尽量避免使用这些治疗,所以这种相关性可能并未得到充分说明。另外,作者还讨论了监测和预防老年心脏毒性的策略。对于老年人,重要的是在长期随访中监测并预防心脏毒性,并且考虑其后期效应的预防和监控。
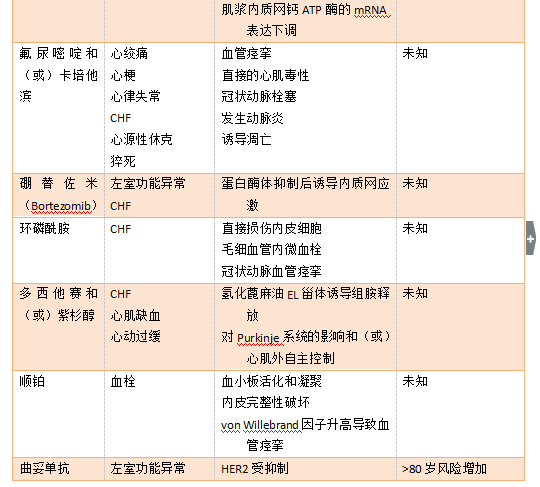
蒽环类:蒽环类是导致充血性心力衰竭(CHF)的经典药物,也可以导致急性心脏毒性如ECG改变、心律失常、心包炎和(或)心肌炎综合征,但比较罕见。急性毒性往往可逆,并不会导致晚期发病的CHF。其心脏毒性的机制可能包括:自由基的形成,诱导凋亡,由于细胞内腺苷酸三磷酸产物变化导致的心脏收缩功能下降,药物相关的心脏谷胱甘肽过氧化酶活性受抑制,线粒体DNA损伤导致呼吸缺陷和(或)拓扑异构酶II的干扰(表1)。一项大规模单中心研究发现蒽环类导致的心肌病中位生存时间大约1年。年龄是独立的危险因素,每十年风险增加20%。阿霉素药物累积剂量在200 mg/m2、400 mg/m2、500 mg/m2和550 mg/m2时CHF的风险分别是2%、5%、16%和26%。65岁以上患者风险是年轻患者的两倍;如果阿霉素累积剂量达到400 mg/m2,风险增加到3倍。输注时间越长,风险越低,且不会影响反应率和生存。脂质体阿霉素可以显著降低心衰的风险(RR 0.38;95% CI 0.24 – 0.59)。心血管疾病风险,如高血压病史、糖尿病、已知的冠心病等,也增加蒽环类相关心脏毒性的风险。
氟嘧啶:氟尿嘧啶(FU)可导致急性心肌缺血,最常见的症状时心绞痛样胸痛,也有心梗、心律失常、心衰、心源性休克和猝死的报道。具体病理机制还不清楚,可能和血管结构破坏和直接的心肌毒性有关。高危因素包括:冠心病史,既往纵膈放疗史,同时应用顺铂治疗。毒性似乎是剂量依赖的,也和输液速度有关。7.6%的应用FU的患者会发生心脏事件,从用药到心脏症状的平均时间为3天。卡培他滨也能够造成心绞痛症状,主要的高危因素是已经存在的冠心病。钙离子通道阻滞剂可能预防氟嘧啶导致的心脏缺血。哪些患者在发生心脏毒性后还可以考虑氟嘧啶治疗,仍有争论。目前再次用药仅限于哪些没有其他替代方案的患者,且必须有严密的监测。
生物制剂:
曲妥单抗:引起的心脏毒性很可能和心肌细胞中人类上皮生长因子受体2(HER2,也叫做ErbB2)受到抑制有关。蒽环类和曲妥单抗联合使用增加这种毒性。一项多中心随机研究中(16.2%患者≥ 60岁),9%发生心脏毒性(左室射血分数下降,CHF,和[或]心源性死亡)。另一项乳腺癌的随机研究要求患者射血分数(EF)超过50%,在蒽环类应用之后继续使用紫杉烷和曲妥单抗,其中47%的患者≥ 60岁,结果20.6%的患者发生了心脏毒性,没有应用曲妥单抗的研究组其比例为11.9%,而曲妥单抗和非蒽环类化疗的研究组心脏毒性比例为9.8%。一项人群为基础的研究中,23.1%的年龄≥ 66岁的早期乳腺癌患者接受了曲妥单抗,CHF比例为29.4%,而那些没有应用曲妥单抗的研究组这个比例为18.9%。应用曲妥单抗的患者中,CHF的高危因素包括:年龄≥ 80岁(HR 1.53),心脏合并症如冠心病(HR 1.82)和高血压(HR 1.24),每周应用一次的和每三周应用一次的情况相比HR为1.33。那些应用曲妥单抗后发生CHF的患者,68.8%的CHF发生在用药开始12个月内。
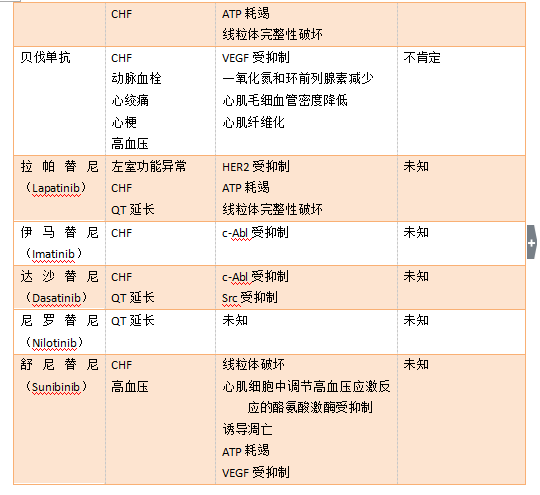
贝伐单抗:贝伐单抗对VEGF的抑制可能导致内皮细胞功能异常和血管排列缺陷,导致组织因子活化,引起血栓栓塞风险增加。另外,VEGF的抑制可能导致一氧化氮和环前列腺素水平降低,导致血管收缩,增加外周血管阻力,最终导致高血压。临床上高血压的发生率为7%到36%。
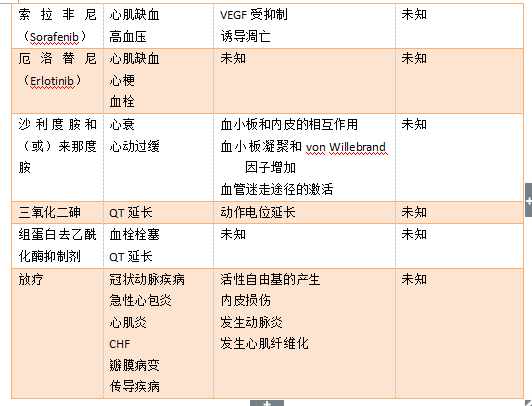
酪氨酸激酶抑制剂(TKIs):这是一类针对特异的分子和信号途径的靶向药物,由于其作用机制和后续毒性差别较大,目前还不清楚其心脏毒性是药物特异的还是种类特异的现象。
放疗:随机对照研究发现乳腺癌的放疗增加缺血性心脏病的风险。具体数据从略。
监测和随诊:临床研究有关心脏毒性事件的定义和分级非常混乱,研究之间难以进行比较分析。目前监测心血管毒性的指南建议用超声心动或闪烁扫描法(acintography)评估射血分数。MRI增强成像可以提供心脏解剖和射血分数的细节数据。但是测量输血分数可能低估了实际心脏损害的情况,因为影像研究难以发现心脏功能发生的微妙改变。血浆心肌标记物如N端前激素脑钠肽和(或)肌钙蛋白可能也有一定作用。国际老年肿瘤协会建议,≥ 70岁患者接受蒽环类药物化疗时,每两到三个周期应用超声心动或闪烁扫描法常规评估EF;他们进一步推荐考虑应用脂质体阿霉素,延长输液时间,或如果EF下降超过10%(即使在正常范围内)即应用右丙亚胺(dexrazoxane)。这个推荐尤其适用于高血压、糖尿病或冠心病的患者。有关风险预测模型的研究还不充分,不足以进行推荐。
预防:右丙亚胺是一种螯合铁剂,可用于降低蒽环类导致的心脏病变,但是尚未在实践中常规应用。ASCO仅建议在阿霉素超过300 mg/m2的患者中应用。主要担心该药降低化疗的抗肿瘤效应。一项系统性综述未发现治疗效果或二次癌症相关的差别,但是该药会导致更严重的3-4级的贫血和白细胞降低。β阻滞剂是否能够保护EF,尚待更大规模的研究证实,尤其是老年患者中。
表1. 抗癌治疗的心血管毒性。ATP,腺苷酸三磷酸盐。CHF,充血性心力衰竭。HER2,人类表皮生长因子受体2。mRNA,信使RNA。VEGF,血管内皮生长因子。

5.癌症系统治疗对认知的影响:对老年患者和生存者看护的意义[5]
老年人多器官系统经历年龄相关的改变,其中就包括大脑的退行性变化,这样系统性治疗和生存结局评估的决策就更加复杂。有持续的证据表明,一些老年癌症患者经过系统性治疗后,神经心理测试和神经影像学发现其大脑选择性认知区域会受到破坏。一个或多个认知区域的破会对于老年患者的日常生活有重要影响。虽然已经有明确的方法预测哪些老年患者风险增加,但是系统性治疗后认知破坏的确切生物学机制并没有很好的理解。已知数据表明,风险可能包括生活因素,如吸烟、遗传倾向、特定的合并症如糖尿病和心血管疾病。这种风险也和生理和认知储备功能相互作用,即使是相同的生物学年龄、相同的疾病种类,老年人的储备功能也差别极大,有的储备极好(生物学上较其年龄年轻),有的储备极差(生物学上较其年龄更老)。目前已经出现了很多评估工具可用于常规临床以预测老年患者认知破坏的情况,并有助于多学科合作,尽管这些工具还没有进行过充分检验其预测效应及对预后的影响。认知功能损害的监测对于老年癌症生存者的长期看护也非常重要。增加老年学训练的癌症看护者,使之在富有经验的多学科团队内工作,对于将癌症系统性治疗的认知效应整合进入常规临床实践中非常关键。
表2. 受癌症系统性治疗影响的认知功能域及在老年癌症患者中的意义。
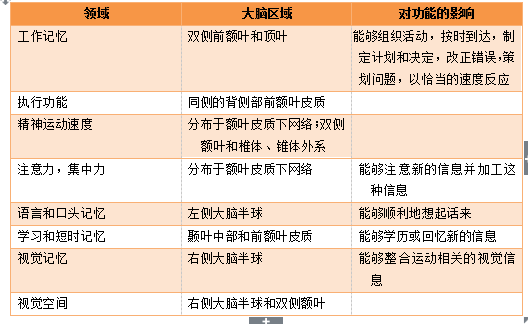
表3. 癌症系统治疗后认知破坏的高危因素及其作用机制。TNF-α-308,肿瘤坏死因子-α-308;SNP,寡核苷酸多态性。

6.为罹患癌症的老年和衰弱成人设计治疗性的临床研究[6]
对于老年患者如何最好地平衡现有癌症治疗的风险和收益,仍然知之甚少;这些患者在临床研究中的代表分量不够。现有的临床研究通常并未包括适用于老年群体的研究终点,如功能的保留、认知和独立性。为了推动老年肿瘤学的进步,癌症和衰老研究组(Cancer and Aging Research Group)在2012年11月和NCI、国立衰老研究所(National Institute on Aging)和肿瘤临床研究联盟(Alliance for Clinical Trials in Oncology)联合举办了一次会议,其目的在于为老年和(或)衰弱成人的治疗性临床研究的设计和完成提出建议并建立研究指南。这次会议旨在识别老年患者癌症临床研究中的知识分歧,并提出临床研究设计以弥补这些分歧。会议最终目标是提出研究以用于老年和(或)衰弱成人的癌症的循证诊疗。这个话题离鄙人的实际临床工作真是差得太远,附表也就不翻译了。
生物标记物整合入癌症和衰老研究中[7]
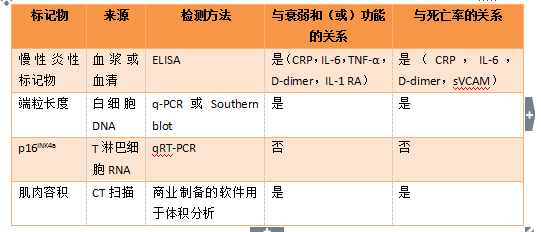
很多肿瘤学家认为生物年龄本身不足以成为判断是否采取某种治疗方案的决定因素。容易测量的标记物提供了功能年龄的评估,对于评价衰弱状态非常理想,可能预测患者癌症治疗的合并症(包括增加的毒性、功能衰退、生活质量下降和生存变差)。已经有数种潜在的标记物对于了解治疗相关的合并症提供了可能性,包括慢性炎症指标,细胞衰老指标,已经用影像学评估肌肉容积以检测肌肉减少症。
表1. 推荐的功能年龄标记物的总结。IL-1RA,IL-1 受体拮抗剂;q-PCR,定量PCR;qRT-PCR,定量实时PCR;sVCAM,可溶性血管细胞粘附分子。
7.国际老年肿瘤协会有关老年癌症患者评估的共识[8]
为了升级国际老年肿瘤协会(International Society of Geriatric Oncology,SIOG)2005年有关老年癌症患者老年学评估(geriatric assessment,GA),协会对下述主题的关键证据进行了回顾,然后发表了共识声明。这些主题包括:执行GA的基础理论;老年肿瘤患者中进行GA的发现;GA发现和总体生存(OS)的关系;GA发现对于肿瘤治疗决策的影响;GA的构成,包括主要领域和工具;在临床诊疗中完成GA的方法。共识声明认为GA对于肿瘤事件极具价值,原因如下:GA能够发现那些常规病史或体格检查不能发现的功能损害,能够预测严重的治疗相关的毒性反应,对于很多肿瘤和治疗情景能够预测OS,能够影响治疗选择和强度。专家组推荐在下述领域应该以GA进行评估:功能状态,合并症,认知,心理健康状态,乏力,社会状态及支持,营养,老年病综合征的出现。尽管目前肿瘤实践领域内已有多种GA评估工具的联合应用以及多种实践模式,专家组尚不能指出哪一种工具或模式更优。有志于老年病的同事最好精读这篇文章。
8.老年肿瘤的个体医学[9]
介绍
癌症治疗远远不是以一应万的尝试。治疗方案却局取决于无数因素,包括肿瘤类型、分期、组织学、肿瘤遗传学和既往治疗史,选择治疗剂量也是如此。剂量选择的因素并不相同,取决于个体化用药,但通常都会包括年龄、合并药物、药物遗传因素、合并症、既往治疗毒性以及肝肾功能。以体表面积激素药物用量是成功衡量效应和毒性的努力,但由于还缺少药物暴露水平和大部分治疗药物结局的相关性,这种方法本身并不充分,尤其是药代动力学改变的患者,以及其他特异性因素可能增加药物毒性的情况,如65岁以上的患者。约56%的男性癌症患者及51%的女性癌症患者其诊断年龄在65岁以上,70%癌症相关的死亡发生在老年人群中。老年人治疗相关的毒性风险增加,因为他们通常存在药物代谢、分布和排泄的改变,以及合并的疾病、经常应用的药物、其他自然衰老过程的生理变化效应(如骨髓储备降低)。其他因素,如药物代谢酶的遗传突变和药物基因组学变化,可能对老年患者有更明显的效应,使其易于发生代谢变化,导致毒性风险增加。
老年人药代动力学的考虑
随着年龄增加,肝脏首过效应和后续的生物学利用度均显著下降。CYP450酶活性的下降临床意义最大,因为大约90%的药物(包括很多肿瘤药物)或多或少通过该系统代谢。人类研究中已经发现了CYP1A2、CYP2C9、CYP2C19、CYP2D6年龄相关的下降。虽然这些变化本身不足以说明剂量的改变,但可能用于推测那些年龄相关的改变对于药物遗传学突变的、对毒性或破坏效应敏感的患者可能更重要。另一方面,酶途径的年龄相关的活性降低可能导致某些途径更加常用。因此少数途径的药物基因组学改变如果变得更为更为常用的话,就可能有更重要的临床价值。目前约50%的药物代谢与CYP3A家族的酶有关。绝大部分体内和体外研究并不支持CYP3A活性的年龄相关的降低,但目前老年人群中高频应用的药物使得CYP3A仍是代谢关注的重点。肾脏分泌功能研究最多,药代动力学推荐的资料更多,但是在老年患者中数据仍然有限。目前肿瘤学中药物剂量更加有效的肾功能计算方法非常有限,标准的计算方法仍是绝大部分药物剂量推荐的常用方法。
CYP2D6和他莫西芬在乳腺癌的老年患者中
对于所有年龄的乳腺癌患者,来曲唑和他莫昔芬相比,可以改善无疾病生存;但是老年患者(≥ 75岁)由于疾病进展和不良反应,很少能完成这两种药物的治疗。两种药物经济学的比较发现,对于固定收入的患者,他莫昔芬可能更加合适。他莫昔芬是一种前体药物,最终通过CYP2D6转化为内昔芬(endoxifen)。目前已经发现了70多种CYP2D6等位基因,不同人种和种族间酶的活性和分布差别很大。年龄相关的代谢改变、CYP2D6基因型以及同时应用的药物及依从性对于内昔芬浓度的最终影响及后续的临床效应,在乳腺癌患者中变化极大。
老年癌症患者紫杉烷相关的毒性
紫杉醇97%多与蛋白结合,通过CYP2C8代谢程主要的代谢产物6α-羟基紫杉醇,不过CYP3A4也产生部分3-羟基紫杉醇。年龄和临床相关紫杉醇暴露的关系是相互矛盾的,药物载体的药代动力学以及总体紫杉醇与未结合药物的比例使之更加复杂化。绝大部分研究显示年龄增加和原始药物暴露剂量以及未结合药物存在直接相关性。已经有研究评估三个年龄人群和紫杉醇暴露以及毒性之间的关系,153例患者每三周接受175 mg/m2的紫杉醇。年纪最大的人群(75岁或更大年纪)和其他较为年轻的两组人群(55至56岁,65至74岁)相比,平均的暴露剂量最高(P = 0.01),这一人群中3级或更严重的中性粒细胞减少比例最高(49%,P = 0.006),其他两组的比例分别为22%和35%。总体紫杉醇的暴露量和不良反应的法神有关,主要是粒细胞减少和神经病变。每周一次的给药方案和每三周一次的方案相比,毒性作用也有差别,主要是3级或更严重神经病变(0% vs. 25%)和粒细胞减少的情况(41% vs. 88%)。紫杉醇引起的神经毒性风险也受到同样可能导致神经病变的合并症的影响,如糖尿病。CYP2C8*3等位基因的遗传多态性和临床相关的神经病变风险增加有关。欧洲人群中2级或更严重神经病变与CYP2C8*3等位基因有关(P = 0.006)。ABCB1(p-糖蛋白,MDR1)的遗传突变也和神经病变有关。但也并非所有研究都支持CYP2C8和ABCB1基因型和毒性的关系。性别、激素状态、紫杉醇方案及肝功能也可能部分解释这种相关性的缺失。
老年癌症患者的阿片类治疗
老年患者的疼痛管理极具挑战性,且疼痛通常治疗不足。这种情况是多因素的,可能是担心药物过量、主观评估、缺少患者报告或教育等因素的结果。老年人群中疼痛药物治疗剂量尤其是阿片类药物需要引起慎重,因为药物代谢发生了改变更易于发生毒性,特别是肾功能下降的情况。药物基因组学突变和年龄相关的代谢效应、同时应用的药物及合并症等,影响药物和剂量的选择。可待因是最常用于轻中度疼痛的阿片类止痛药,它也通过CYP2D6代谢最终转化为吗啡。根据患者基因组状态可以分为四种:超级迅速代谢者(ultra-rapid metabolizers,UMs),快速代谢者(extensive metabolizers,EMs),中等代谢者(intermediate metabolizers,IMs)和不良代谢者(poor metabolizers,PMs)。尽管已有研究比较不同基因型药物代谢的差别,但是CYP2D6基因型年龄相关的改变对于可待因效力和毒性的相互作用仍属未知,从而提供了今后临床研究的机遇。
治疗药物监测:氟尿嘧啶
治疗药物监测(therapeutic drug monitoring,TDM)可能有助于理想地选择药物剂量。卡培他滨是口服的氟嘧啶类产物,最终通过胸苷磷酸化酶代谢为氟尿嘧啶(FU)。FU的毒性通过二氢嘧啶脱氢酶(DPD)的异化途径进行去毒和消除。大约85%的初始药物通过DPD进行分解,因此DPD缺乏的患者服用FU时毒性反应增加,尤其是胃肠道和血液学反应。年龄相关的FU的药代动力学参数没有清楚说明。总体上三分之一的患者会出现严重的毒性反应,一半的接受了常规剂量的患者并未实现治疗反应。这说明个体化的FU治疗既有价值,尤其是容易发生白细胞减少等不良反应的老年患者。
大量研究已经发现系统性连续输注FU的暴露(以AUC计算)和毒性的关系。以药代动力学指导的FU治疗患者(平均年龄71岁)总体缓解率更高(33.7% vs. 18.3%,P = 0.004),中位总体生存更好(22 vs. 16个月),毒性事件更少(P = 0.003)。
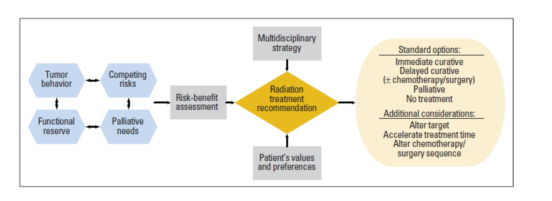
9.老年患者的放疗:临床决策的框架工作[10]
老年患者中,放疗在治愈性和缓解性癌症治疗中扮演了重要角色。应该在治疗效果和毒性的基础上,综合考虑个体化风险-收益评估,再做出放疗推荐。作者评估了几种显著影响老年患者放疗效果和毒性的临床因素,总结如下。首先,老年患者中,局灶区域肿瘤行为在某些疾病部位较为惰性,但是在其他部位可能更具侵袭性。对局灶区域肿瘤复发风险的评估为放疗期待收益的程度和时长提供了信息。第二,在患者有关健康需要的全部范围和时程内,对抗肿瘤vs. 非癌性死亡和患病风险的评估应该在整体上满足癌症治疗优先权选择。第三,功能性储备的评估将有助于预测患者急性反应的耐受情况,从而辨别那些患者不太可能从治疗收益,或哪些存在治疗合并症的风险。有效的放疗选择包括即刻的治愈性治疗、延迟的治愈性治疗以及不治疗。这些情况还需考虑放疗的靶目标、剂量,或者与化疗和(或)手术的序贯安排。最后,如果达不到治愈目的,缓解性放疗对于控制症状、有效地改善生活治疗仍有其价值。作者的目的是设计决策框架,在多学科范围内整合那些有助于放疗肿瘤学家设计策略性治疗推荐意见的因素。未来仍然需要搞清楚如何精准应用高级技术进行治疗性和缓解性放疗,从而增强老年患者的风险-收益问题,并在这一人群中更确切地量化治疗效果。
文章还附有老年患者放疗的随机对照研究的表格,可惜没有妇科放疗的研究设计。
图1. 老年癌症患者放疗肿瘤学决策的概念性框架。
10.老年癌症患者有关支持治疗的考虑[11]
老年患者尤其容易经历发热性白细胞减少,以及化疗诱导所致的恶心、贫血、骨质疏松(特别是乳腺癌和前列腺患者)、抑郁、失眠和疲乏等并发症。这些情况往往还合并其他年龄相关的慢性疾病,如糖尿病和心脏病等。很多患者,可以通过调整生活方式和药物治疗改善症状。因此,改善老年癌症患者生活方式的关键在于了解他们特异性的需要,并且熟悉急诊治疗的选择。作者对这些症状进行了很好的推荐。现将几张表格翻译如下,并摘录部分正文内容。
骨骼健康:WHO认为如下因素为骨量丢失的高危因素(而不是低骨量的危险因素):年龄,女性性别,吸烟,50岁前骨折史,父母髋骨骨折史,低BMI(< 20 Kg/m2),每天饮酒超过3次,使用激素,合并其他疾病(如风湿性关节炎或维生素D缺乏)。Fracture Risk Assessment Tool(FRAX)流程就是应用上述危险因素对10年内骨折风险进行评估的较好工具。
贫血:WHO定义的贫血在男性中为血红蛋白小于13.5 g/dl,在女性中小于12.0 g/dl。对于65岁或更大年纪的女性,血红蛋白在12.5-14 g/dl之间死亡率和残疾率最低。超过50%的患者其贫血是可以诊治的,包括缺铁性贫血和营养性贫血。三分之一的患者,贫血原因并不明显,可能包括早期病态造血,肾功能不全,性腺功能低下,维生素D和铜缺乏,还可能包括造血干细胞的耗竭。至少一半的贫血患者有两种以上相互交错的病因,在大约30-50%缺铁的老年成人中,由于萎缩性胃炎、幽门螺杆菌感染和乳糜疾病可能造成铁吸收不良。维生素B12缺乏的主要原因包括萎缩性胃炎和药物作用(质子泵抑制剂和二甲双胍)。红细胞生成素相对缺乏是绝大部分老年患者贫血的原因,也可能是癌症相关贫血的因素。在老年个体中,贫血是死亡、功能性依赖、术后昏迷、充血性心力衰竭和跌倒的危险因素。贫血也增加认知破坏和痴呆的风险。认知破坏的患者更易贫血;贫血的患者在随后数年中更易发生认知破坏。贫血也降低对放疗的反应,增加细胞毒化疗药物的骨髓毒性。因为大多数抗肿瘤药物结合在红细胞上,因此毒性作用随着贫血而增加。贫血也可能是乏力的一个原因,而乏力是癌症最常见的合并症,可能导致功能性依赖。所有贫血患者都应该评估贫血的原因并尽快予以治疗。缺铁患者可能需要静脉铁剂治疗,因为他们可能无法正常吸收铁剂。癌症患者应该慎重输血。如果血红蛋白没有降到7-8 g/dl之下,一般不推荐输血。红细胞生成素刺激因子(ESA)应该根据指南和不同国家药监部门的规定应用。这些药剂对于改善乏力和生活质量是有效的,但有些研究提示其可能造成深静脉血栓。在几乎所有的研究中,如果血红蛋白小于12 g/dl,ESA的应用是安全的。
抑郁:抑郁的发生率和流行率随着年龄增加而增加。如果不予适当治疗,抑郁将增加残疾、患病和死亡的风险。抑郁可以以“亚临床”的形式呈现,即并不满足所有经典抑郁表现的情况。亚临床抑郁也和医疗合并症、残疾、死亡和全面爆发的抑郁症等风险增加有关。但并不清楚哪种治疗最佳。但至少应该加强看护,如果亚临床症状干扰了正常活动或生活质量,应立即干预。癌症患者中抑郁尤其高发,且影响预后。老年癌症患者中抑郁更加常见和严重。实际上,老年患者的自杀风险通常难以识别。绝大部分抑郁患者没有得到恰当诊断和治疗。可用于评估老年个体抑郁症的工具包括Geriatric Depression Scale和Center for Epidemiologic Studies Depression Scale。确切治疗应该尽可能转至老年精神医师那里。首先诊断抑郁的卫生执业者应该采取一系列干预,包括:确认患者对于健康的关注,死亡的风险,残疾,不适,理解刺激抑郁综合征的社会矛盾,对患者的监护人给予支持,管理多重药物治疗,调查和抑郁相关的潜在疾病(如甲状腺功能低减)。如果应用药物治疗,最好避免三环类抗抑郁药,因为它会导致便秘、尿潴留、口干等不良反应,且用药从最小剂量开始,并关注不良反应。
乏力:乏力是癌症及相关治疗最常见的慢性合并症,但其机制并不清楚。癌症相关的乏力其流行率随着年龄上升而上升。预防措施包括癌症治疗期间的日常锻炼,这已经得到荟萃分析的证实。治疗中乏力体验最少的患者也是那些得益于锻炼最多的患者。这说明开始锻炼的最佳时机是乏力发生之前。化疗期间的营养支持也可能预防或消除乏力。抗抑郁药的作用没有明确证据。治疗贫血对于预防乏力也非常重要。
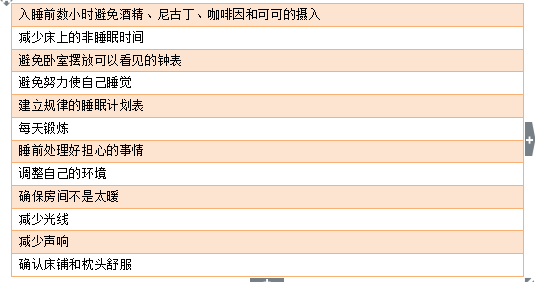
失眠:失眠是癌症患者的常见主诉,发生率是普通人群的2-5倍。失眠也随着年龄增加而增加。65岁以上老人中超过50%的人会经历某种形式的睡眠障碍。失眠症状也与合并症的数目有关。老年癌症患者评估睡眠有五条关键标准:至少有一个月的睡眠困难;睡眠障碍导致严重的不安甚或破坏;需要排除一种主要的睡眠疾病(如发作性睡眠症,睡眠呼吸暂停等);排除精神性合并症(抑郁或焦虑);排除常见的医学疾病、药物影响或药物滥用。应该考虑睡眠卫生。治疗失眠的方案包括认知行为治疗和(或)安眠药。安眠药可能对于短期内控制失眠有效,但是老年癌症患者长期应用的风险和收益并不清楚。而且还要考虑到药物的不良反应,如日间嗜睡,认知破坏,缺少运动协调等。失眠对老年癌症患者有重要的影响。失眠的患者看急诊、寻求医疗咨询和使用非处方药的频率更高。失眠还会导致身心障碍的时间更长,并增加功能性破坏。失眠患者车祸风险更高。睡眠障碍相关的死亡率更高。
表1. 癌症风险指数中支持治疗的多国相关性(MASCC评分)。60岁以上即被视为危险因素;评分21分或更高者是低危患者,其他情况都有感染合并的高危风险。
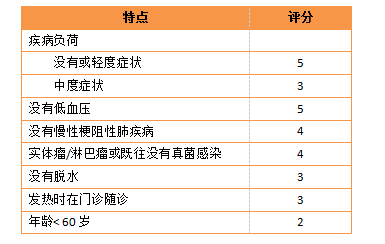
表2. MASCC/ESMO止吐指南:急性期和延迟期预防的总结。推荐的5-HT3RA是阿洛诺司琼,昂丹思琼,口服的多拉司琼和托烷司琼。延迟期阿瑞吡坦的使用取决于急性期阿瑞吡坦/福沙吡坦的应用。5-HT3RA,5-羟色胺-3受体拮抗剂;AC,蒽环类抗生素-环孢菌素;DEX,地塞米松;DRA,多巴胺受体拮抗剂。*如果没有神经激肽-1受体拮抗剂,那么阿洛诺司琼是AC方案中较好5-HT3RA的一类。

表3. 老年癌症患者自杀相关的急性和慢性危险因素。
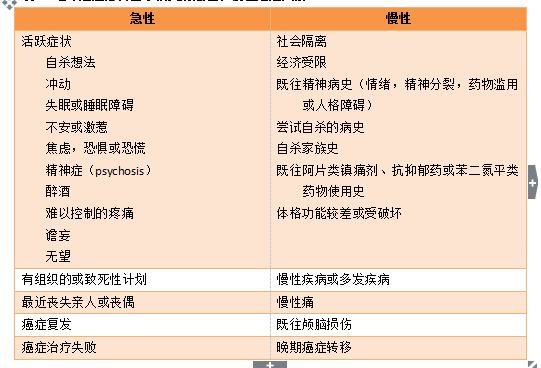
表4. 影响有效乏力治疗的障碍。

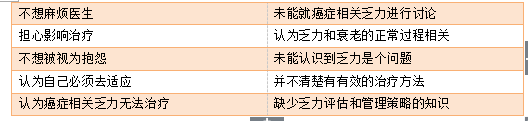
表5. 睡眠卫生。
11.老年癌症患者有关手术的考虑[12]
本文主要讨论年龄和几种癌症手术治疗风险的相关性,包括结肠癌、肺癌、肝癌、头颈部癌症等。有效的手术需要安全的实施、合理的术后生活期望以及对生活质量的满足。可能适合老年患者的治疗决策应该充分考虑来自对老年病综合征(如衰弱,功能和认知受限,营养不良,合并症,多重药物治疗等)评估得到的数据,还要考虑社会支持。术后看护包括预防和治疗老年人更常见的合并症,如术后昏迷,功能减退等,还要考虑收容照看(institutionalization)的要求。对于实体肿瘤,手术仍然是最好的治疗方案,单纯的年龄不应成为治疗决策的决定因素。如果有充分的术前风险分析、功能评估以及肿瘤学预测,老年癌症患者手术的死亡率、患病率和年轻患者相同。如果手术已经证明是合适的治疗选择,患者不应因为他们的年龄而拒绝这种选择。
老年病评估对于预测手术结局的重要性已经得到报道(表1)。对于行胸腹部大型手术的患者,术前认知破坏,低白蛋白水平,既往摔倒史,低红细胞压积,任何的功能依赖,以及高负荷的合并症,与6个月的死亡率和出院后收容照看的风险最为密切。对于术后需要在ICU住院的患者,基础的认知破坏和术后合并症种类增加、住院延长、6个月内死亡率等均有关。在Preoperative Assessment of Cancer in the Elderly(PACE)研究中,功能依赖、乏力和异常的执行状态导致术后合并症的相对风险增加50%。对于65岁以上的患者,较低的Mini-Mental State Examination评分和较大的年纪与胆囊切除术后发生谵妄的风险显著相关,那些发生谵妄的患者更可能再次入院和再次手术。在进行胰十二直肠切除的患者中,较大的年龄和较差的老年学评估评分能够预测主要的合并症、更长的住院时间以及手术相关的ICU入院。
老年患者合并症的风险增加,通常称为“住院灾难”,包括谵妄、营养不良、尿失禁、褥疮、抑郁、摔倒、应用管制(use of restraints)、感染、功能衰退、药物不良反应和死亡。三分之一的住院老年成人会发生新的残损,至少20%的老年患者会在住院期间发生谵妄。术后谵妄增加住院时间、花费、患病率和死亡率。
12.老年实体肿瘤患者的靶向治疗[13]
靶向药物治疗尚没有老年患者特定的临床研究,绝大部分数据是从包含老年患者的较大研究中推导出来的。因此目前推荐相关治疗时,需要认识到老年临床研究参与者并不代表日常实践中的情况。恰当的药物选择、剂量和监护,患者选择和老年学评估是非常重要的。如果能够谨慎应用,这些治疗对于老年癌症患者安全和有效治疗将是巨大的进步。表2就是基于重要研究的治疗推荐。表中可见,大部分靶向药物的毒性数据在老年患者中非常有限;如果有这样的数据,其在老年患者中的毒性也通常会增加。
这篇综述未能就妇科肿瘤进行更多讨论。
文献来源:
[1] Tew WP, Muss HB, Kimmick GG, et al. Breast and Ovarian Cancer in the Older Woman. J Clin Oncol. 2014.
[2] Falandry C, Bonnefoy M, Freyer G, et al. Biology of Cancer and Aging: A Complex Association With Cellular Senescence. J Clin Oncol. 2014.
[3] Rowland JH, Bellizzi KM. Cancer Survivorship Issues: Life After Treatment and Implications for an Aging Population. J Clin Oncol. 2014;32(24):2662-2668.
[4] Accordino MK, Neugut AI, Hershman DL. Cardiac Effects of Anticancer Therapy in the Elderly. J Clin Oncol. 2014;32(24):2654-2661.
[5] Mandelblatt JS, Jacobsen PB, Ahles T. Cognitive Effects of Cancer Systemic Therapy: Implications for the Care of Older Patients and Survivors. J Clin Oncol. 2014;32(24):2617-2626.
[6] Hurria A, Dale W, Mooney M, et al. Designing Therapeutic Clinical Trials for Older and Frail Adults With Cancer: U13 Conference Recommendations. J Clin Oncol. 2014.
[7] Hubbard JM, Cohen HJ, Muss HB. Incorporating Biomarkers Into Cancer and Aging Research. J Clin Oncol. 2014;32(24):2611-2616.
[8] Wildiers H, Heeren P, Puts M, et al. International Society of Geriatric Oncology Consensus on Geriatric Assessment in Older Patients With Cancer. J Clin Oncol. 2014.
[9] Walko CM, McLeod HL. Personalizing Medicine in Geriatric Oncology. J Clin Oncol. 2014.
[10] Smith GL, Smith BD. Radiation Treatment in Older Patients: A Framework for Clinical Decision Making. J Clin Oncol. 2014;32(24):2669-2678.
[11] Naeim A, Aapro M, Subbarao R, et al. Supportive Care Considerations for Older Adults With Cancer. J Clin Oncol. 2014;32(24):2627-2634.
[12] Korc-Grodzicki B, Downey RJ, Shahrokni A, et al. Surgical Considerations in Older Adults With Cancer. J Clin Oncol. 2014;32(24):2647-2653.
[13] Kelly CM, Power DG, Lichtman SM. Targeted Therapy in Older Patients With Solid Tumors. J Clin Oncol. 2014;32(24):2635-2646.
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号